THE Elektrokemija je veja fizikalne kemije, ki preučuje reakcije, pri katerih pride do prenosa elektronov (oksi-redukcijske reakcije), in njihove pretvorba v električno energijo, pa tudi obratni postopek, to je pretvorba električne energije v energijo kemije.
Prvi postopek je tisto, kar se dogaja v Baterije. Baterije so naprave, ki jih poleg elektrolita (prevodne raztopine) tvorita dve elektrodi (pozitivni pol, ki je katoda, in negativni pol, ki je anoda). Z zunanjim vodnikom se elektroni prenesejo iz anode na katodo in tvorijo električni tok, ki se uporablja za vklop neke naprave. Baterije so sestavljene iz več celic, povezanih zaporedno ali vzporedno.
To je spontan proces in energija se oskrbuje, dokler se kemijska reakcija ne izčrpa (tako kot pri primarnih celicah in baterijah, kot sta Leclanchéjeva suha celica in baterija alkalna), ali v primeru reverzibilnih reakcij lahko uporabimo potencialno razliko in reakcijo obrnemo, ponovno tvorimo reaktante in napolnimo baterijo, ki je pripravljen za ponovno uporabo (to velja za baterije in sekundarne baterije, kot so svinec, ki se uporablja v avtomobilih, in litij-ionski, ki se uporabljajo v napravah mobilni telefon).

Primarne celice in baterije v ospredju, v drugem pa polnjenje sekundarnih baterij (svinčev in litijev ion)
Ne ustavi se zdaj... Po oglaševanju je še več;)
Povratni postopek ni spontan in se imenuje elektroliza. Elektroliza je prehod električnega toka, ki prihaja iz generatorja, kot je celica ali baterija, skozi ionsko tekočino. Če je tekočina nekaj staljene snovi, imamo a magmatska elektroliza, če pa gre za vodno raztopino, imamo vodna elektroliza.
Pri prehajanju električnega toka čez tekoči medij generator "potegne" elektrone iz pozitivnega pola (anoda - je nasprotno od baterija) elektrolitske celice in jih prenese na negativni pol (katodo), to pomeni, da se katoda reducira, anoda pa oksidacija. Tako se električna energija, ki jo dovaja generator, pretvori v redoks reakcije (kemična energija). Spodaj je shema elektrolize vode:
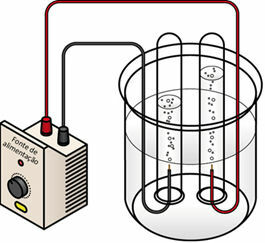
Shema elektrolize vode
Elektroliza se široko uporablja v industriji pri proizvodnji pomembnih snovi, kot so aluminij, klorov plin, kovinski natrij, in za čiščenje ali zaščito različnih kovin, kot pri galvanizaciji ali postopkih galvanizacije, ki zajemajo prevleko nekaterih predmetov s kovino, kot so posrebrenje, bakrenje, nikljanje, pozlata in kromiranje; ko je jeklo prevlečeno s cinkom, se to imenuje pocinkanje.
V oddelku Elektrokemija na naši spletni strani boste našli več podrobnosti o vseh vidikih, povezanih s celicami in baterijami, pa tudi z elektrolizo.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Kaj je elektrokemija?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletroquimica.htm. Dostop 27. junija 2021.
Kemija

Elektroliza, raztopine elektrolitov, električni tok, oksidacijsko-redukcijske reakcije, spontani kemični postopek, kemijski postopek nespontano, transformator, umetna preobrazba, industrije, alkalijske kovine, alkalna zemlja, plin vodik, plin kl