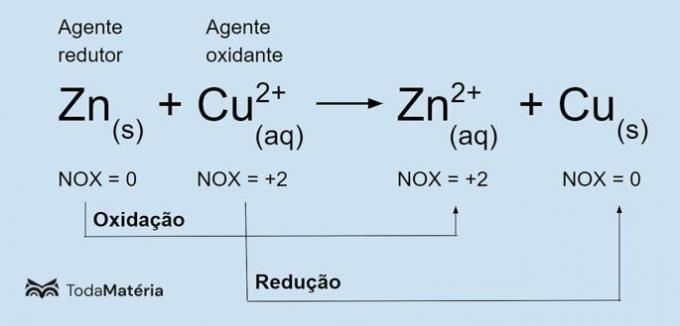
Elektroliza gre za nespontanski proces, torej tisti, ki se ne pojavi naravno, pri katerem snovi nastajajo z električnim praznjenjem v spojinah, stopljenih ali raztopljenih v vodi. V tem procesu električni tok doseže stekleno posodo (elektrolitski rezervoar), ki ima dve inertni elektrodi (ki ne trpijo oz. oksidacija niti zmanjšanje), ki ga tvori grafit ali platina. Te elektrode so povezane z električnim virom (običajno a bobni) in potopimo v sol ali osnovo, stopljeno ali raztopljeno v vodi. Tako kot baterijo, elektroliza ima katodo (kjer pride do redukcije) in anodo (kjer pride do oksidacije).
Povzetek
Elektroliza je spontan proces;
Lahko nastanejo enostavne ali sestavljene snovi;
Lahko se pojavi pri staljeni topljeni snovi (magmatska elektroliza);
Lahko se pojavi pri topljeni raztopljeni vodi (vodna elektroliza);
Pri katodi se kation vedno reducira;
Anion na anodi vedno oksidira.
Glej tudi:Pridobivanje aluminija iz elektrolize

Vrste elektrolize
Gre za elektrolizo, ki nastane, ko se na staljeni ionski spojini izvede električni izpust. Ionska spojina je tista, ki jo tvori ionska vez, kot je a
sol ali a osnova anorganski. Ko govorimo o staljeni spojini, se po drugi strani sklicujemo na spojino, ki prehaja iz trdnega v tekoče stanje.- Primer magmatske elektrolize
Ko opravimo fuzijo kalijevega klorida (KCl), ta sol izloči postopek disociacije in sprosti kalijev kation (K+) in jodid anion (l-).

Disociacijska enačba za kalijev klorid
Ko električni tok s temi ioni doseže elektrolitsko celico, se kalijev kation zmanjša in tvori kovinski kalij (K), jodid-anion pa oksidira in tvori trden jod (I2).
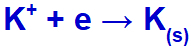
Enačba trdne tvorbe kalija
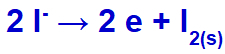
Enačba trdne tvorbe joda
Gre za elektrolizo, ki se pojavi, ko se električni izpust izvaja na vodni raztopini (ima vodo), ki jo tvori sol ali anorganska osnova.
- Primer vodne elektrolize
Ko v vodi raztopimo natrijev klorid, ta disociira in voda se ionizira:

Ionizacija vode in enačbe disociacije natrijevega klorida
Kot natrijev kation (Na+) spada v družino IA, hidronijev kation (H+) prehaja skozi izpust in se reducira ter tvori plin vodik (H2).
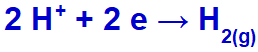
Enačba tvorbe vodikovega plina
Kot klorid (Cl-) ni kisikov (nima kisika) in ni fluorid (F-), se odvaja, oksidira in tvori klorov plin (Cl2).

Enačba tvorbe klorovih plinov
Selektivni ionski izpust
Med postopkom elektrolize v vodnem mediju (raztopina, ki jo tvorita voda in topljena snov) bomo vedno imeli dva kationa: hidronij iz vode in kateri koli drug iz solna disocijacija (primer topljene snovi). Imeli bomo tudi dva aniona: hidroksil, ki prihaja iz vode, in drugega, ki prihaja iz soli.

Ioni iz ionizacije vode in disociacije soli
- Selektivni izpust za kation in anione
Če kation iz topljene snovi spada v družino IA, IIA ali IIIA, je hidronij (H+) se bo znižal;
Če kation, ki prihaja iz topljene snovi, ne pripada zgoraj omenjenim družinam, bo utrpel zmanjšanje.
Če ima anion iz topljene snovi v svoji sestavi kisik ali je fluorid (F-), hidroksid (OH-) bo podvržen oksidaciji;
-
Če anion iz topljene snovi nima zgoraj navedenih lastnosti, bo podvržen oksidaciji.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Znano je, da ima voda sposobnost samoionizacije in proizvaja hidronijeve ione (H+) in hidroksid (OH-), vendar je ta ionizacija precej omejena. To dejstvo dokazuje neučinkovitost čiste vode pri vodenju električnega toka.
Kot naprimer elektroliza vključuje električni izpust, za izvedbo elektrolize vode je treba raztopiti topljeno snov kar daje prednost selektivnemu odvajanju hidronija in hidroksida (kot je razvidno iz teme o odvajanju selektivno).
Če dodamo natrijev sulfat (Na2SAMO4), na primer, v sredini bomo imeli natrijeve katione (Na+) in hidronija (H+), pa tudi hidroksidne anione (OH-) in sulfat (SO4-2). Ko torej električni tok prispe v elektrolitski rezervoar:
hidronij se bo izpustil in zmanjšal, ker natrij spada v družino IA;
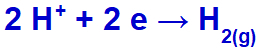
Enačba tvorbe vodikovega plina
hidroksid se bo izpraznil in oksidiral, ker ima sulfat kisik v svoji sestavi.
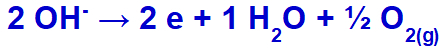
Enačba tvorbe kisikovih plinov
Ko sta bila oba iona (kation in anion), ki prihajata iz vode, izpuščena, pravimo, da je prišlo do elektrolize vode.
Glej tudi: Kvantitativni vidiki elektrolize
Proizvodnja preprostih snovi, kot je vodikov plin (H2), kisikov plin (O2) itd .;
Proizvodnja sestavljenih snovi, kot so natrijev hidroksid (NaOH), žveplova kislina (H2SAMO4) itd;
Prevleka dela z določeno kovino, kot sta baker (baker) in zlato (pozlačevanje);
Uporabite za odstranjevanje določene kovine iz rude.
Rešene vaje iz elektrolize
Primer 1 - (Vunesp) Vodna raztopina CuCℓ2 je podvržen elektrolizi z uporabo platinskih elektrod. Pravilna trditev je:
a) Na katodi pride do zmanjšanja ionov Cu2+.
b) Na anodi pride do oksidacije Cu ionov2+.
c) Na katodi nastaja klorov plin.
d) Del platinske anode se raztopi in tvori Pt2+.
e) Produkti te elektrolize bi bili drugačni, če bi bila elektroliza CuCl2 je bila ognjena (fuzija).
a) Pravilno. Ko CuCl2 se raztopi v vodi, imamo hidronijeve katione (H+) in baker II (Cu+2). Ker kation bakra II ne spada v družine IA, IIA in IIIA, je reduciran.
b) Napačno, saj se na anodi kloridni anion (Cl) oksidira-), ki v svoji sestavi nima kisika in ni fluorid (F-).
c) Neresnično, ker na katodi pride do redukcije kationa bakra II, zato nastane kovina bakra.
d) Napačno, saj elektrode iz platine ali grafita pri elektrolizi samo prevajajo elektriko in v procesu ne sodelujejo.
e) Neresnično, saj je magmatska elektroliza bakrovega klorida II (CuCl2) bi predstavljal popolnoma enake produkte kot vodni, saj bi bili prisotni ioni baker II (Cu+2) in klorid (Cl-1).
Primer 2- (UFRN) Upoštevajte naslednje sisteme:
JAZ. Staljeni natrijev klorid;
II. Vodna raztopina natrijevega klorida;
III. Taljeni natrijev hidroksid;
IV. Vodna raztopina natrijevega hidroksida.
Tisti, ki lahko zagotovijo natrij, kadar so izpostavljeni elektrolizi, so:
a) samo I in II.
b) samo I in III.
c) samo II in IV.
d) samo III in IV.
e) I, II, III in IV.
Sistemi, ki dovajajo kovinski natrij kot produkt na katodi, sta I in III.
I- Edini kation, ki je prisoten v mediju, je natrijev kation, zato se le ta lahko reducira in tvori kovinski natrij.
II- Ta sistem ne zagotavlja kovinski natrij, ker je bil natrijev klorid raztopljen v vodi, zato imamo v sredini prisotnost natrijevih kationov (Na+) in hidronija (H+) - to je tisti, ki trpi zaradi zmanjšanja, saj natrij spada v družino IA.
III- Edini kation, ki je prisoten v mediju, je natrijev kation (ker je bil material podvržen fuziji), zato se le ta reducira in tvori kovinski natrij;
IV- Ta sistem ne zagotavlja kovinski natrij, ker je bil natrijev hidroksid raztopljen v vodi, zato imamo v sredini prisotnost natrijevih kationov (Na+) in hidronija (H+) - to je tisti, ki trpi zaradi zmanjšanja, saj natrij spada v družino IA.
Jaz, Diogo Lopes Dias