Reverzibilne reakcije se običajno začnejo z določeno količino reagentov. Ko se začne neposredna reakcija, se sčasoma porabijo ti reagenti za tvorbo izdelkov, se koncentracija reagentov posledično zmanjša, medtem ko koncentracija izdelkov povečuje. Nato se začne tudi inverzna reakcija, ki proizvaja tudi reaktante, dokler stopnja razvoja (hitrost) neposrednih in inverznih reakcij ne ostane enaka in doseže t.i. kemično ravnotežje.
V ravnovesju je ravnotežna konstanta Kc, ki se v bistvu izraža z:
|
Kc = [izdelki]koeficient v uravnoteženi kemijski enačbi [reagenti]koeficient v uravnoteženi kemijski enačbi |
To pomeni, če upoštevamo naslednjo splošno ravnotežno reakcijo:
a A + b B ↔ c C + d D
Ker so male črke koeficienti, velike črke pa snovi, bo ravnotežna konstanta te reakcije:
Kc = [Ç]ç. [D]d
[THE]The. [B]B
Več podrobnosti o tem je razvidno iz besedila Konstanti ravnotežja Kc in Kp. To besedilo nam kaže tudi nekaj pomembnega: da nam vrednosti Kc lahko pokažejo, ali koncentracija reagentov in proizvodi enaki ali če je eden večji od drugega in posledično če se kemijsko ravnotežje premakne v reakcija.
Torej moramo določiti vrednost Kc. Če želite to narediti, ne pozabite, da so ti izračuni eksperimentalni, zato si oglejmo nekaj primerov reakcij in podatke, pridobljene iz njih.
Nekaj, kar je zelo koristno pri teh izračunih, je, da napišete tabelo, podobno spodnji, in sledite korakom, omenjenim v njej:

Tabela za organiziranje podatkov, uporabljenih za izračun ravnotežne konstante
Zdaj pa pojdimo na vajo:
Primer 1: V zaprti posodi s prostornino 2 L pri temperaturi 100 ° C je 20 mol N2O4. Začne se pojavljati naslednja reverzibilna reakcija: N2O4 ↔ NE2. Po določenem času je bilo ugotovljeno, da je reakcija dosegla kemično ravnovesje in da 8 mol NO2 je nastala. Kolikšna je vrednost ravnotežne konstante Kc pri temperaturi 100 ° C?
Ne ustavi se zdaj... Po oglaševanju je še več;)
Resolucija:
Uporabimo tabelo:

Tabela, uporabljena za reševanje primera izračuna konstante ravnotežja
Upoštevajte, da v vrstici, kjer so bile zapisane količine, ki reagirajo in nastanejo, vemo, da so bili porabljeni 4 moli N2O4, ker je razmerje 1: 2 in je nastalo 8 mol NO2.
Zdaj samo nadomestite vrednosti, najdene v izrazu ravnotežne konstante Kc te reakcije:
Kc = [PRI2]2
[N2O4]
Kc = (4 mol / l) 2
(8 mol / l)
Kc = 2 mol / l
Vrednost Kc je brezrazsežna, nima enote, povezane z velikostjo.
Zdaj pa si poglejmo primer, ki vsebuje tudi izdelke od začetka:
2. primer: V zaprti posodi s prostornino 5 L pri temperaturi T so 2 mola vodikovega plina, 3 moli jodnega plina in 4 moli vodikovega jodida. Reakcija vstopi v kemijsko ravnotežje pri temperaturi T in izkaže se, da je v posodi 1 mol vodikovega plina. Kakšen graf predstavlja to ravnotežje in kolikšna je vrednost ravnotežne konstante Kc pri temperaturi T?
Resolucija:
Uporaba tabele:
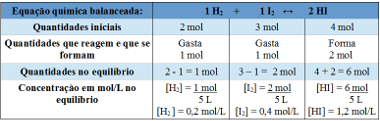
Tabela, ki se uporablja za določanje ravnotežne konstante
Graf, ki prikazuje spremembe koncentracij reagentov in izdelkov v mol / L, dokler ne dosežejo ravnotežja, lahko dobimo z:

Graf kemijskega ravnovesja, ki prikazuje spremembe koncentracij reagentov in izdelkov
Zdaj najdemo vrednost ravnotežne konstante:
Kc = __ [HI]2__
[H2 ]. [JAZ2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Izračun ravnotežne konstante Kc"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm. Dostopno 28. junija 2021.
Kemija

Preizkusite svoje znanje in se naučite več s tem seznamom rešenih vaj o kemijskih tehtnicah. S pomočjo tega gradiva boste lahko bolje razumeli, kako delati ravnotežne konstante (Kp, Kc in Ki), ravnotežni premik, pH in pOH ter ravnotežje v tako imenovanih puferskih raztopinah.



