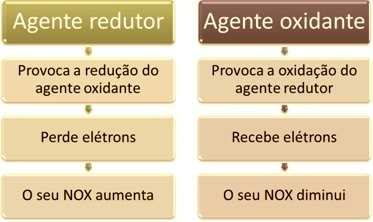
Ena glavnih značilnosti, ki ločuje oksidacijsko-redukcijsko reakcijo (oz redoks) drugih je prisotnost oksidacijskega in redukcijskega sredstva, ki ga je mogoče opredeliti na naslednji način:
Na primer, poglejte spodnjo kemijsko reakcijo, kjer aluminij (Al) korodira v vodni raztopini klorovodikove kisline (HCl). Atomi aluminija prenašajo elektrone v katione H+(tukaj) in proizvedejo kation Al3+(tukaj):
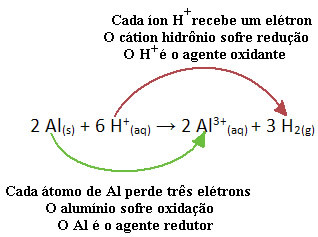
Upoštevajte, da ker je Al prenašal elektrone, to pomeni, da povzročil je zmanjšanje kationov H+(tukaj); zato je poklican reduktor. Že kation H+(tukaj) odstranili elektrone iz aluminija, povzroča oksidacijo iz te kovine; zato deluje kot a oksidacijsko sredstvo.
V vsakdanjem življenju je veliko primerov delovanja oksidantov in reducentov. Oglejte si nekatere od njih in se spomnite, da se v vseh primerih redukcija zgodi hkrati z oksidacijo; torej, če obstaja redukcijsko sredstvo, obstaja tudi oksidacijsko sredstvo.
- Primeri reducentov:
- V fotografskih filmih: fotografski filmi vsebujejo na svetlobo občutljive srebrove soli. Na mestih, kjer se pojavlja svetloba, pride do zmanjšanja ionov Ag +, kar povzroči kontrast, opažen pri negativih.

- Vitamin C: Vitamin C (L-askorbinska kislina) je močno reducirajoče sredstvo v vodni raztopini. Ima izjemno možnost oksidacije, zato se pogosto uporablja, zlasti v živilih, kot je antioksidant, to je, da se doda drugim živilom in jih zaradi svoje zaščiti pred morebitno oksidacijo žrtev. Primer je sadje, kot so jabolka in hruške, ki v stiku s kisikom v zraku potemnijo, ker oksidirajo. Ko pa sadju dodate majhno količino pomarančnega ali limoninega soka (ki vsebuje vitamin C) rezano, to preprečuje, da bi prišlo do te reakcije, ker vitamin C deluje kot redukcijsko sredstvo in pred sadjem oksidira.

- Vodikov plin: vodikov plin (H2) se uporablja pri raketnem pogonu in velja za eno najpomembnejših energetskih alternativ, saj pri njegovem zgorevanju sprosti veliko energije in nič onesnaževal. V tej reakciji vodik deluje kot redukcijsko sredstvo, ki ga kisik oksidira.
- Primeri oksidantov:
- Pri proizvodnji kisa: ko je vino izpostavljeno zraku, se spremeni v kis, katerega glavna sestavina je ocetna kislina. To je zato, ker etilni alkohol ali etanol, ki je prisoten v vinu, v stiku z atmosferskim kisikom oksidira, kar povzroči ocetno kislino. Tako je kisik oksidacijsko sredstvo. Tudi izvor izraza "oksidacija" je povezan z reakcijo s kisikom.

Ne ustavi se zdaj... Po oglaševanju je še več;)
- V rji: kot je navedeno v prejšnjem primeru, kisik deluje kot oksidacijsko sredstvo za alkohol; in to počne tudi v stiku z različnimi kovinami, na primer železom, kar povzroči proces rjavenja. Poleg kisika v zraku so v tem primeru druga oksidacijska sredstva tudi voda ali kisla raztopina.
- V belilih: učinek beljenja belil je posledica prisotnosti naslednjih dveh reducentov: o hipokloritni anion (običajno v obliki natrijeve soli - NaOCl), prisoten na primer v belilu; in vodikov peroksid (H2O2), ki se trži kot vodikov peroksid. Ti dve spojini imata zelo močno nagnjenost k oksidaciji in povzročanju redukcije drugih kemičnih vrst. Zato so odgovorni za oksidativne snovi, ki dajejo temnim barvam izdelke. Na primer, v celulozi se lignin razgradi in postane lažji in voljnejši. V primeru odstranjevanja madežev in beljenja tkanin ti oksidanti povzročajo oksidacijo organskih molekul, kot so maščobe in barvila.

- V alkotestih: preprost alkotest za enkratno uporabo je sestavljen iz prozorne epruvete, ki vsebuje vodno raztopino dikromatske soli kalija in silicijevega dioksida, navlaženo z žveplovo kislino; pomešano z oranžno barvo. Ta sol v stiku z alkoholnimi hlapi, ki jih vsebuje vdih pijanega voznika, reagira in spremeni barvo v zeleno. To pomeni, da je povzročena oksidacija etanola (alkohola) v etanal.

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Koncept in primeri redukcijskega sredstva in oksidanta"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm. Dostopno 28. junija 2021.
Kemija

Atmosfersko korozijsko odporno jeklo, krom, nikelj, izdelano iz surovega železa v plavžih, odpornost na visokotemperaturna oksidacija, nerjaveče jeklo, skupina železovih zlitin, odpornih proti oksidaciji in koroziji, proizvodnja delov za vozilo
Kemija

Kako deluje alkotest, koncentracija alkohola, alkotest, reakcije z etilnim alkoholom, vrste alkotesti, kalijev dikromat, gorivne celice, katalizator, sproščanje elektronov, ocetna kislina, vodik, konce
Kemija

Fotoobčutljive leče, oksidacijsko-redukcijske reakcije, izguba ali pridobivanje elektronov, fotosintetske leče v sončnih očalih, sestava fotokromatskega stekla, tetraedrski atomi kisika, kristalna struktura srebrovega klorida, ultravijolična svetloba, kovina srebra



