THE hidroliza soli med močnimi kislinami in bazami pojavi se, kadar kation v soli ne vpliva na anion v vodi, anion v soli pa ne vpliva na kation v vodi. Hidroliza med kationi in anioni soli in vode nastane le, če je nastali produkt šibka kislina, šibka baza ali oboje. Korak za korakom razumite hidrolizo soli med močnimi kislinami in močnimi bazami:
a) 1. korak: ionizacija vode
Voda je snov, ki ima sposobnost trpljenja avtoionizacija, to pomeni, da proizvaja hidronijev kation (H+) in hidroksid anion (OH-) iz njegove strukture.
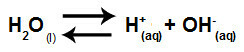
Enačba, ki predstavlja samoionizacijo vode
b) 2. korak: Disocijacija soli
Ko sol dodamo vodi, gre skozi postopek disociacije. Ker je sol ionska spojina, se v vodi sprostijo njeni kationi in anioni, kot je prikazano v spodnji enačbi:
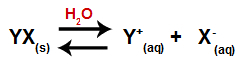
Enačba, ki predstavlja disociacijo katere koli soli
c) Korak 3: Hidroliza soli močnih kislin in baz
Za močno kislino: ko se anion soli kombinira s H+ vode, da nastane HCl, HBr, HI ali druga kislina, v kateri je odštevanje števila kisikov s številom vodikov enako ali večje od 2, bomo imeli
močna kislina. Zato do kombinacije med omenjenimi ioni ne pride.Za močne temelje: kadar se kation soli iz družin IA (alkalijske kovine) ali IIA (zemeljskoalkalijske kovine, razen magnezija) kombinira z OH- vode bo nastala a močna podlaga. Zato do kombinacije med omenjenimi ioni ne pride.
Ko solni ioni ne sodelujejo z vodnimi ioni, imamo naslednjo enačbo:
Ne ustavi se zdaj... Po oglaševanju je še več;)
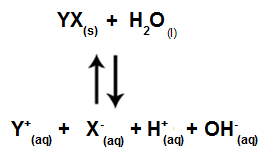
Enačba, ki prikazuje vse prisotne ione v raztopini
Če povzamemo, ker solni ioni ne vplivajo na vodne ione, solni ioni ne spodbujajo sprememb v končni raztopini. Zato lahko enačbo hidrolize soli med močnimi kislinami in močnimi bazami napišemo samo z enačbo ionizacije vode.
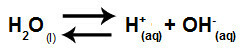
Enačba, ki predstavlja hidrolizo močnih kislin in baz
d) Primer hidrolize soli med močnimi kislinami in bazami
Ko v vodo dodamo sol kalijevega klorata (KClO3), sol disociira in sprosti kalijev kation (K+) in klorat anion (ClO3-) v sredini.
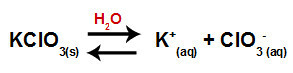
Disociacijska enačba za kalijev klorat
Pomembno je vedeti, da je voda podvržena samoionizaciji in mediju zagotavlja kation hidronija (H+) in hidroksid anion (OH-). Zdaj moramo oceniti interakcijo med solnimi in vodnimi ioni.
Ko je H+ sodeluje s ClO3-tvori klorovodikovo kislino (HclO3). Ker je odštevanje števila kisikov s številom ionizirajočih vodikov v klorovodikovi kislini 2, je močno. Zato do interakcije med ioni ne pride.
Ko K kation+ sodeluje z OH anionom-, tvorimo močno bazo, saj je kalij alkalna kovina. Zato do interakcije med ioni ne pride.
Enačba, ki predstavlja hidrolizo soli med močnimi kislinami in bazami pri raztapljanju kalijevega klorata v vodi, je:
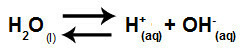
Kemijska enačba hidrolize kalijevega klorata
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Solna hidroliza med močnimi kislinami in močnimi bazami"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm. Dostopno 28. junija 2021.
Kemija

Preizkusite svoje znanje in se naučite več s tem seznamom rešenih vaj o kemijskih tehtnicah. S pomočjo tega gradiva boste lahko bolje razumeli, kako delati ravnotežne konstante (Kp, Kc in Ki), ravnotežni premik, pH in pOH ter ravnotežje v tako imenovanih puferskih raztopinah.


