THE Теория октетов утверждает, что для того, чтобы атом химического элемента был стабильным, он должен приобрести электронную конфигурацию благородного газа, то есть у него должно быть восемь электронов на валентной оболочке или два электрона, если атом имеет только первую электронную оболочку. (К).
Бериллий имеет атомный номер, равный 4. Следовательно, у вашего атома 4 электрона, и его электронное распределение в основном состоянии определяется выражением:

Электронная конфигурация бериллия
Это означает, что бериллий имеет 2 электрона в своей последней оболочке, принадлежащих к семейству 2A (щелочноземельные металлы). Таким образом, у него была бы тенденция отдавать эти два электрона, получая заряд 2+, то есть у него была бы тенденция к образованию ионных связей.
Однако наблюдается, что атомы бериллия образуют ковалентные связи с разделением электронов, как показано в соединении, образованном ниже, гидрид бериллия (BeH2):
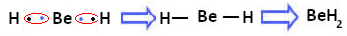
Образование ковалентных связей бериллия с водородом.
Обратите внимание, что в этом случае бериллий стабилен с менее чем восемью электронами в его валентной оболочке, потому что делится своими электронами, как атомы водорода, теперь у него четыре электрона в последнем слой. Следовательно, это
исключение из правила октетов.Но ковалентная связь обычно возникает из-за неполных орбиталей элемента. Например, как показано ниже, водород имеет неполную орбиталь, поэтому он образует только одну ковалентную связь. Кислород имеет две неполные орбитали и образует две ковалентные связи. Азот, в свою очередь, имеет три неполные орбитали и, следовательно, образует три ковалентные связи:
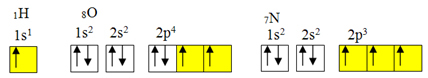
Электронные распределения водорода, кислорода и азота
Однако, как уже было показано, бериллий не имеет неполных орбиталей.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Так почему же образуются ковалентные связи?
Объяснение в теория гибридизации, в котором говорится, что когда электрон с орбитали получает энергию, он «прыгает» на крайнюю пустую орбиталь, пребывая в возбужденном состоянии, происходит слияние или смешивание неполных атомных орбиталей, генерирование гибридные орбитали которые эквивалентны друг другу и отличаются от исходных чистых орбиталей.
Например, в случае бериллия электрон с подуровня 2s получает энергию и переходит на пустую орбиталь подуровня 2p:

Возбужденное состояние бериллия для образования гибридных орбиталей
Таким образом, бериллий имеет две неполные орбитали, способные образовывать две ковалентные связи.
Обратите внимание, что одна орбиталь находится на подуровне «s», а другая - на «p», поэтому связи, которые будет выполнять бериллий, должны быть разными. Однако это не то, что происходит, потому что с феноменом гибридизация, эти неполные орбитали, которые сформировались, будут смешиваться, образуя две орбитали, называемые гибриды или же гибридизированный, которые равны друг другу. Кроме того, поскольку эти две гибридные орбитали произошли от s-орбитали и p-орбитали, мы говорим, что эта гибридизация относится к типу зр:

Образование гибридизации бериллия sp
Поскольку гибридные орбитали одинаковы, ковалентные связи, которые бериллий создает с атомами водорода, также будут такими же:

Взаимопроникновения гибридных орбиталей бериллия с s-орбиталями атомов водорода
Обратите внимание, что затем он создает две сигма-связи типа s-sp (σs-sp).
Дженнифер Фогача
Окончила химический факультет