Текст Аддитивные реакции показали, что эти типы органических реакций названы так, потому что реагент добавляется к органической молекуле, разрывая связи между атомами углерода. В этом тексте был показан случай алкенов, здесь мы уже рассмотрим, как это происходит с алкинами, или то есть с теми углеводородами (образованными только атомами углерода и водорода), которые имеют связь тройной.
Уязвимым местом алкинов является именно тройная связь, где связь пи (π) -типа может быть разорвана (присоединение частичное) или дважды (полное добавление) и дают соответственно новые соединения с двойными (алкены) или одинарными связями (алканы).
Рассмотрим примеры реакций присоединения в алкинах:
1. Добавление водорода или гидрирование:
В этом случае молекула H2 добавляется к алкину с использованием катализатора, который обычно представляет собой порошкообразный никель (Ni), платину (Pt) или палладий (Pd). Из-за необходимости использования катализатора эту реакцию также называют каталитическое гидрирование
и это происходит поэтапно: на первой стадии вы получаете алкен, а на второй стадии, которая более медленная, вы получаете алкан.Если используемый катализатор сильный, такой как никель и платина, в реакции непосредственно образуется алкан. Палладий в смеси с BaSO4 это слабый катализатор, который производит алкен. Также можно использовать частичный ингибитор катализатора, чтобы достичь только алкена. Эта реакция также протекает при высоких давлениях и температурах.
Затем мы добавляем водород к этану, получая этилен, а затем этан:

2. Добавление галогенов или галогенирование:
Пи-связь алкина разрывается, и к молекуле добавляются два атома галогена (элементы из семейства 17A Периодической таблицы, наиболее часто используемые: Cl2 и Br2), образуя вицинальный дигалогенид, означающий, что два атома галогена связаны с соседними атомами углерода. Реакция может продолжаться, разрывая другую пи-связь и добавляя к молекуле еще два атома галогена.
В приведенном ниже примере у нас есть такой вид дополнения к взятке:
ClCl ClCl
││ ││
H ─C ≡ C CH3 + Cl2 → H ─ C ═ C CH3 + Cl2 → H ─ C ─ C CH3
││
ClCl
ALCINO DI-HALETTE TETRAHALETTE
3. Добавление галогенидов водорода (галогенгидриды или гидрогалогениды):
Здесь к алкину добавляют галогенид водорода, а также может иметь место частичное или полное добавление. Важным аспектом этого типа реакции является то, что она следует за Правило марковниковато есть водород связывается с более гидрогенизированным углеродом (с присоединенным большим количеством атомов водорода), а галоген связывается с менее гидрогенизированным углеродом.
При полном гидрогалогенировании образуется гемический дигалогенид, то есть соединение, которое имеет два атома галогена, присоединенные к одному и тому же углероду.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Смотреть:
ЧАСBr Hbr
││ ││
H ─C ≡ C CH3 + HBr → H ─ C ═ C CH3 + HBr → H ─ C ─ C CH3
││
ЧАСbr
ГЕМИЧЕСКИЙ ДИ-ГАЛОГИД АЛКИНО ГАЛИДА
Важным примером этого типа реакции является реакция, которая происходит при добавлении хлористого водорода к этину с образованием хлорэтен или винилмонохлорид, который является мономером, образующим поливинилхлоридный полимер, более известный под его аббревиатурой ПВХ.
ЧАСClHCl
││ ││
H ─C ≡ С ─ H + HCl → H ─ C ═ С ─ H + HCl → H ─ C ─ C ─ H
││
ЧАСCl
ЭТИНО-ХЛОРОЭТЕН 1,1-ДИХЛОРОЭТАН
(Мономер ПВХ)
ПВХ - это вещество, широко используемое в промышленности для производства различных товаров, таких как сандалии, флаконы с лекарствами, медицинские приборы, пластиковые штаны для младенцев, сумки и т. Д. покрытия для проводов, игрушки, обивка мебели, автомобильная обивка, плащи, пластиковая обувь, виниловые пластинки, полы, упаковочная пленка, трубы, используемые в водопроводных трубах и канализация и т. д.
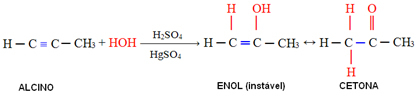
4. Добавление воды (гидратация):
В этой реакции вода реагирует с алкином, первоначально образуя енол, который подвергается молекулярной перегруппировке и превращается в альдегид (в случае алкинов меньшего размера, чем ацетилен). Энол и альдегид остаются в динамическом равновесии с преобладанием альдегида. Это случай Динамическая конституциональная изомерия или таутомерия.
Пример:

В случае алкинов большего размера, чем ацетилен, соблюдается правило Марковникова, и енол дает кетон:
Дженнифер Фогача
Окончила химический факультет