Согласно Первому закону термодинамики, в любом термодинамическом процессе количество тепла Q полученная системой равна произведенной ею работе плюс изменение ее внутренней энергии.
При постоянном давлении тепло, передаваемое системой с внешней средой, используется для работы и изменения внутренней энергии. Во многих практических ситуациях системы подвергаются воздействию атмосферного давления, как в случае химической реакции. На рисунке выше показана фотоэлектрическая диаграмма этого типа процесса.
В этом случае в уравнении Первого закона
Q = τ + ∆U
ни один из членов не равен нулю. Работа написана как функция от изменения объема volumeV, например:
τ = P.∆V
Для частного случая идеального одноатомного газа энергию можно записать следующим образом:

Следовательно, мы можем записать Первый закон термодинамики как функцию ΔV:


Теплообмен со средой составляет (5/2) P.ΔV, и 40% от общей суммы, что соответствует P.ΔV, используется для выполнения работы; и (3/2) P.ΔV, что соответствует 60% от общей, используются для изменения внутренней энергии. Этот результат справедлив для идеального одноатомного газа.
Тепло связано с изменением температуры (согласно закону идеального газа) следующим образом:
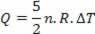
Таким образом, количество подводимого тепла можно рассчитать по изменению температуры или по изменению объема.
Домициано Маркес
Закончил факультет физики
Источник: Бразильская школа - https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm

