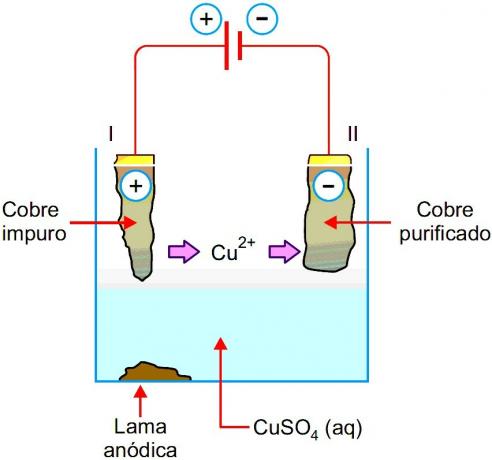
Элементы или электрохимические элементы и батареи - это устройства, в которых химическая энергия самопроизвольно преобразуется в электрическую..Ячейка состоит всего из двух электродов и электролита, а батарея представляет собой набор батарей, включенных последовательно или параллельно.
В первичные батареи - неперезаряжаемые устройства, поскольку, когда реакция окисления-восстановления, происходящая внутри них, прекращается, их нужно выбросить.
Для каждого оборудования указывается тип аккумулятора, и среди основных используемых в настоящее время аккумуляторов основными являются: Сухие элементы Leclanché (обычные батареи или кислотные элементы), щелочные батареи и литиевые / диоксид марганцевые батареи.
Посмотрите, что их отличает и для какого оборудования они подходят:
- Сухие клетки Лекланше:
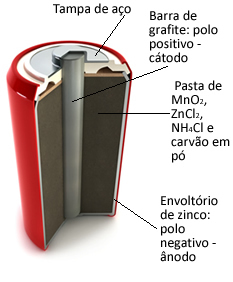
Эти груды в основном образованы цинковой оболочкой, разделенной пористой бумагой и центральным графитовым стержнем, окруженным диоксидом марганца (MnO2), древесный уголь (C) и влажная паста, содержащая хлорид аммония (NH4Cl), хлорид цинка (ZnCl2) и вода (H2О).
О цинк работает как анод, теряя электроны; это графит работает как катод, проводящие электроны к диоксиду марганца:
Половина реакции анода: Zn (s) → Zn2+(здесь) + 2 и-
Катодная полуреакция: 2 MnO2 (водн.) + 2 NH41+(здесь) + 2e- → 1 Мн2О3(s) + 2NH3 (г) + 1 час2О(1)
Глобальная реакция: Zn (s) + 2 MnO2 (водн.) + 2 NH41+(здесь) → Zn2+(здесь) + 1 млн2О3 (с) + 2NH3 (г)
Этот тип батареи подходит для оборудования, которое требует легкой и непрерывной разрядки, такого как пульт дистанционного управления, настенные часы, портативное радио и игрушки.
Вы можете получить более подробную информацию о происхождении, функционировании, долговечности, ddp, опасностях и мерах предосторожности, которые необходимо соблюдать с этими батареями, в тексте «Сухой стек лекланше”.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
- Щелочные батареи:
Его действие очень похоже на работу сухих элементов Leclanché, однако с той лишь разницей, что вместо хлорида аммония (который является кислой солью) добавляется сильное основание, в основном гидроксид натрия (NaOH) или гидроксид калия (КОН).
Половина реакции анода: Zn + 2 OH → ZnO + H2O + 2e-
Катодная полуреакция: 2 MnO2 + H2O + 2e-→ Mn2О3 + 2 ОН
Общая реакция: Zn +2 MnO2→ ZnO + Mn 2О3

Щелочные батареи более выгодны, чем кислотные, в том смысле, что они имеют большую долговечность, в том числе обычно обеспечивают на 50-100% больше энергии, чем обычная батарея того же размера, плюс меньше опасности утечки.
В основном они предназначены для устройств, требующих быстрой и более интенсивной загрузки, таких как радиоприемники, портативные CD / DVD и MP3-плееры, фонарики, цифровые камеры и т. Д.
Также прочтите текст Щелочные батареи.
- Литиевые / диоксид марганцевые батареи:
Эти батареи легкие и генерируют большое напряжение (около 3,4 В), поэтому их часто используют в небольшом оборудовании, таком как часы и калькуляторы. В отличие от предыдущих случаев, его формат - валюта, как показано на следующем изображении:

Анод - литий, катод - диоксид марганца, а электролит - солевой раствор:
Половина реакции анода: читать →читать+ + и−
Катодная полуреакция: MnO2 + читать+ + и−→MnO2(ли)
Общая реакция: Li + MnO2 → MnO2(ли)
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Наиболее распространенные типы элементов и первичных батарей»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Доступ 27 июня 2021 г.