Аккумулятор это система, в которой химическая энергия спонтанно преобразуется в электрическую.
В 1836 году английский химик и метеоролог Джон Фредерик Даниэль (1790-1845) построил сваю, отличную от известной в то время: сваю Алессандро Вольта. В этой куче он соединены между собой два электрода, которые представляют собой системы, состоящие из металла, погруженного в водный раствор соли, образованной катионами этого металла..
Один из электродов, медный электрод, состоял из медной пластины, погруженной в раствор сульфата меди (CuSO4). Другой электрод представлял собой цинковый электрод, состоящий из цинковой пластины, погруженной в раствор сульфата цинка (ZnSO4).
Эти два электрода были соединены между собой электрической цепью, содержащей лампу, потому что, если бы она включалась, это указывало бы на возникновение электрического тока.
Кроме того, между ними был соляной мост. Этот мостик состоял из U-образной стеклянной трубки, содержащей концентрированный водный раствор хорошо растворимой соли, такой как, например, хлорид калия (KCl (водн.)). Концы пробирки покрывают ватой или агаром.
Ниже представлена структура этой ячейки или электрохимической ячейки, которая стала известна как ячейка Даниэля. Помня, что каждый электрод называется полуячейкой.
При замкнутой цепи лампа включается и через некоторое время цинковая пластина подверглась коррозии и ее масса уменьшилась, тогда как медная пластина наоборот, ее масса увеличивается (как показано на рисунке ниже). Также отмечается, что наблюдается увеличение концентрации в моль / л ионов Zn2+ и уменьшение ионов Cu2+.
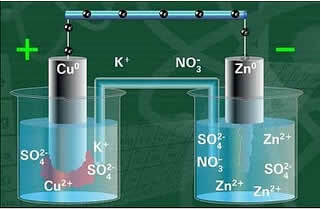
Схема стека Даниэля.
Почему это происходит?
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Чтобы разобраться, давайте посмотрим на реакции, которые происходят на каждом электроде отдельно.
В цинковом электроде происходит следующая равновесная реакция:
Zn (т) ↔ Zn2+(здесь) + 2 и-
Это означает, что металлический цинк (из пластины) подвергается окислению, то есть отдает два электрона катиону цинка (из раствора) и становится Zn2 +. Также происходит обратное: катион цинка, присутствующий в растворе, получает два электрона, подаренных цинком, и становится металлическим цинком. Следовательно, происходит непрерывный процесс окисления и восстановления.
То же самое относится и к медному электроду, который будет иметь глобальную реакцию в динамическом равновесии: Cu (s) ↔ Cu2+(здесь) + 2 и-
Даниэлл понял, что, если он соединит эти два электрода, более реактивный из них отдаст свои электроны менее реакционноспособному катиону вместо того, чтобы делать это с катионами в собственном растворе. В этом случае цинк является наиболее реакционноспособным и подвергается окислению, отдавая медь электронами, что приводит к уменьшению ее массы. Электрод, который подвергается окислению, - это отрицательный полюс, называемый анодом. Медный электрод подвергается восстановлению, катион меди получает два электрона от цинка и называется катодом (положительный полюс).
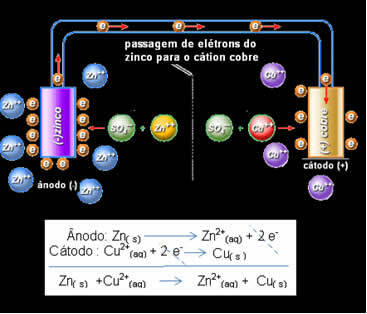
Прохождение электронов и глобальное уравнение стека Даниэля.
Выше у нас есть глобальное уравнение для этого стека, которое получается сложением двух полуреакций. Его изображение или химическое обозначение производится по следующему правилу:

Итак, для стека Даниэля у нас есть:
Zn / Zn2+// Жопа2+ / задница
Дженнифер Фогача
Окончила химический факультет
Бразильская школьная команда
Физико-химический - Химия - Бразильская школа
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Куча Данилла»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Доступ 28 июня 2021 г.