Существует раздел науки, изучающий скорость химических реакций и факторы, которые на нее влияют, это химическая кинетика. Химические реакции можно определить как совокупность явлений, в которых два или более веществ реагируют друг с другом, давая начало различным соединениям. Химическое уравнение - это графическое представление химической реакции, где реагенты появляются в первом члене, а продукты - во втором.
А + В  C + D
C + D
Реагенты Продукты
Знание и изучение реакций, помимо того, что они очень важны с производственной точки зрения, также связаны с нашей повседневной жизнью.
Скорость реакции - это то, как быстро реагенты расходуются или как быстро образуются продукты. Горение свечи и образование ржавчины - примеры медленных реакций. В динамите разложение нитроглицерина - быстрая реакция.
Скорость химических реакций определяется эмпирическими законами, называемыми законами скорость, рассчитанная по влиянию концентрации реагентов и продуктов на скорость реакция.
Химические реакции протекают с разной скоростью, и их можно изменить, потому что помимо концентрация реагентов и продуктов, скорости реакции зависят также от других факторов нравиться:
Концентрация реагента: чем выше концентрация реагентов, тем быстрее будет реакция. Для реакции между двумя или более веществами необходимо, чтобы молекулы столкнулись, чтобы произошел разрыв связей с последующим образованием новых. Количество столкновений будет зависеть от концентрации A и B. Смотрите картинку:
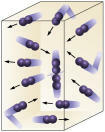
Молекулы сталкиваются чаще, если
мы увеличиваем количество реагирующих молекул.
Легко видеть, что из-за более высокой концентрации будет увеличиваться столкновение между молекулами.
контактная поверхность: увеличение контактной поверхности увеличивает скорость реакции. Пример - когда мы растворяем измельченную таблетку сонризаля, и она растворяется быстрее. чем если бы он был целым, это происходит потому, что мы увеличиваем контактную поверхность, которая реагирует с Воды.
Давление: при увеличении давления в газовой системе скорость реакции увеличивается.
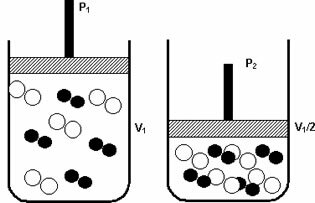
Увеличение давления от P1 до P 2 уменьшало объем от V1 до V1 / 2, ускоряя реакцию из-за сближения молекул.
На приведенном выше рисунке показан пример, так как с уменьшением объема во втором контейнере будет увеличиваться давление, усиливающее столкновения молекул и, как следствие, увеличение скорости движения реакция.
Температура: когда температура системы повышается, также увеличивается скорость реакции. Повышение температуры означает увеличение кинетической энергии молекул. В повседневной жизни мы можем наблюдать этот фактор, когда готовим, и увеличиваем пламя плиты, чтобы еда быстрее достигла степени готовности.
Катализаторы: Катализаторы - это вещества, которые ускоряют механизм, не подвергаясь постоянным изменениям, то есть во время реакции они не расходуются. Катализаторы позволяют реакции идти по альтернативному пути, который требует меньше энергии активации, заставляя реакцию протекать быстрее. Важно помнить, что катализатор ускоряет реакцию, но не увеличивает выход, то есть дает такое же количество продукта, но за более короткий период времени.
Лирия Алвес
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm
