А электросфера это область атома, в которой электроны Они расположены. Точнее, электросфера состоит из атомных орбиталей, определяемых решением уравнения Шрёдингера. Впервые определенная моделью Резерфорда, электросфера получила значительные успехи во время действия атомной модели Бора.
Электросферу можно разделить на слои (или энергетические уровни), поскольку электроны имеют определенную (прерывистую) энергию. У атомов с двумя и более электронами оболочки делятся на подоболочки (или подоболочки). Электросфера чрезвычайно важна для понимания свойств атома и понимания образования химических связей.
Читайте также: Как расщепляется атом?
Темы в этой статье
- 1 - Краткое описание электросферы
- 2 - Видеоурок по электросфере
- 3. Что такое электросфера?
- 4 – Слои электросферы
- 5 - Функция электросферы
- 6 - Связь между электросферой и атомной структурой
- 7 - Решенные упражнения на электросфере
Краткие сведения об электросфере
Электросфера – это область атома, в которой расположены электроны.
Он состоит из атомных орбиталей — волновых функций, которые являются решениями уравнений Шрёдингера.
Его концепция началась с модели Эрнеста Резерфорда.
Электроны удерживаются в электросфере за счет притяжения к атомному ядру.
Основные успехи в понимании электросферы произошли во время концепции модели Нильса Бора.
Он состоит из слоев (или энергетических уровней), которые представляют собой области определенной энергии.
У атомов с более чем одним электроном оболочки делятся на подоболочки (или подоболочки).
Электросфера важна для понимания некоторых свойств, таких как атомное подобие, стабильность, атомный радиус, энергия ионизации, сродство к электрону, а также понимание образования связей химикаты.
Видеоурок по электросфере
Что такое электросфера?
Электросфера определяется как область атомной структуры, в которой расположены электроны. В более глубоких интерпретациях мы говорим, что он состоит из атомных орбиталей, волновых функций, которые являются решениями уравнения Шрёдингера. Математическое выражение атомной орбитали в квадрате представляет плотность вероятности местоположения электрона в данной точке.
О Концепция электросферы начала формироваться с Атомная модель Эрнеста Резерфорда, в котором электроны вращаются вокруг плотного положительного ядра. Позже Нильс Бор представил более существенные интерпретации электросферы, смешав концепции квантовой механики.
Не останавливайся сейчас... Дальше будет после рекламы ;)
Слои электросферы
Электроны удерживаются в электросфере за счет притяжения к атомному ядру. Однако известно, что эти электроны находятся в оболочках, энергия которых четко определена. Такие слои можно также назвать энергетическими уровнями.
К такому выводу пришли после экспериментов по спектроскопии. Например, при подаче электрического тока на газ H2 При низком давлении свет излучается H2. В этом состоянии образуются ионы H.+ и электроны, которые вернутся к ионам H+ и образует возбужденные (заряженные) разновидности H+. Для сброса избыточной энергии ионы H+ высвобождать энергию в виде электромагнитного излучения (света) и рекомбинировать в газ H.2 снова.
Возможно, вы помните, что когда белый свет проходит через призму, он распадается на непрерывный спектр (похожий на радугу); однако того же не происходит со светом, исходящим от H2: при прохождении такого излучения через призму в спектре излучения H наблюдаются только яркие линии с определенной длиной волны.2, известные как спектральные линии.
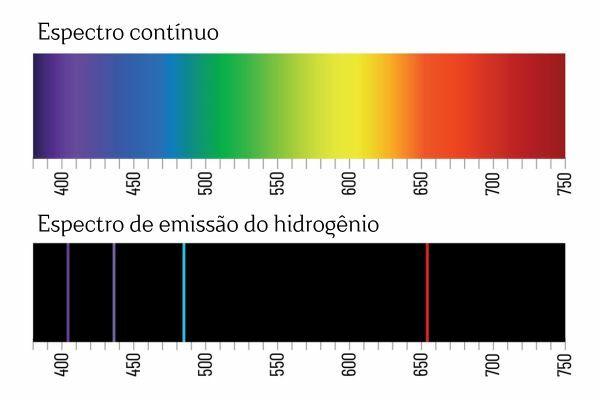
Интерпретация спектров излучения элементов (с четко выраженными спектральными линиями) заключается в том, что электрон, в атоме, не может представлять никакой энергии, а скорее в четко определенных количествах (так называемые энергетические пакеты). Если бы у электронов не было таких энергетических ограничений, спектр излучения элементов был бы непрерывным, как у белого света, проходящего через призму.
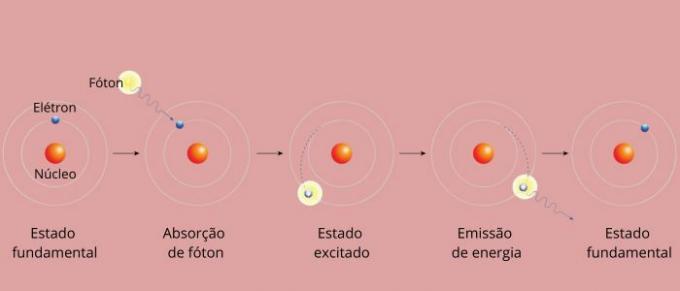
Каждая спектральная линия элемента стала называться энергетическим уровнем. (или слоя, как мы привыкли говорить). Эти линии возникают, когда электрон переходит с одного разрешенного уровня энергии на другой в процессе изменения энергии, известном как электронный переход.
Во время электронного перехода электрон переходит с более низкого энергетического уровня на более высокий энергетический уровень. Возвращаясь на исходный уровень, он излучает избыточную энергию посредством электромагнитного излучения (света), давая начало спектральной линии, значение излучаемой энергии которой пропорционально значению, определяемому уравнением Ридберг.
Йоханнес Ридберг был шведским спектроскопистом, который создал уравнение для определения направления спектральных линий на основе работы швейцарского профессора Иоганна Бальмера. Удельная энергия каждого слоя определяется путем решения соответствующего уравнения Шредингера.
Каждый электронный слой имеет разрешенное количество электронов.. В настоящее время определены семь электронных слоев, обозначенных буквами от K до Q в алфавитном порядке или буквой n, где n ≥ 1. Таким образом, слой K — это слой, где n = 1 и так далее. Количество электронов, разрешенных на оболочку, показано в следующей таблице.
Уровень энергии |
Слой |
Максимальное количество электронов |
1 |
К |
2 |
2 |
л |
8 |
3 |
М |
18 |
4 |
Н |
32 |
5 |
О |
32 |
6 |
п |
18 |
7 |
вопрос |
8 |
Для атомов гидрогеноида (только с 1 электроном, например H, He+, Ли2+), все атомные орбитали имеют одинаковую энергию (мы называем их вырожденными орбиталями); однако в атомах с двумя и более электронами возникает очень важный эффект — электрон-электронное отталкивание. Следствием этого факта является то, что орбитали каждого слоя начинают иметь разные энергии и, следовательно, слои начинают описываться как подслои (или подуровни).
Для текущих атомов каждый слой можно разложить на четыре подуровня., представленный буквами «s» (от англ. острый), «р» (от англ. основной), «д» (от англ. распространение) и «f» (от англ. фундаментальный).
Каждый подуровень поддерживает максимальное количество электронов, определенное расчетами и экспериментами. Подуровень «s» поддерживает до 2 электронов; подуровень «p» — до 6 электронов; подуровень «d» — до 10 электронов; подуровень «f» — до 14 электронов. Слой K — единственный, который допускает только одну орбиталь и, следовательно, имеет только один подуровень.
Уровень энергии |
Слой |
Подуровни |
1 |
К |
1 с |
2 |
л |
2с, 2п |
3 |
М |
3с, 3п, 3д |
4 |
Н |
4с, 4п, 4д, 4ф |
5 |
О |
5с, 5п, 5д, 5ф |
6 |
п |
6с, 6п, 6д |
7 |
вопрос |
7с, 7п |
Функция электросферы
Электросфера каждого атома может быть использован для объяснения различных свойств и поведения атома..
Такие свойства, как атомный радиус, ионный радиус, энергия ионизации и сродство к электрону, имеют значения, которые являются прямым следствием электронной конфигурации электросферы, точнее, называется валентной оболочкой, который на самом деле является самой внешней занятой электронной оболочкой атома или иона.
А сходство между атомами одной и той же группы Периодической таблицы также является следствием электронной конфигурации. валентной оболочки. В химических процессах мы выбираем атомы из одной и той же группы таблицы Менделеева, насколько это возможно. заместители, и это вполне правдоподобно, поскольку эти атомы имеют одинаковую электронную конфигурацию в слое валентности.
К химические связи, которые возникают между атомами с образованием ионных и ковалентных соединений (молекул), происходят также за счет взаимодействий между электросферами атомов.
Прочтите тоже: Атомная модель Шрёдингера — способ описания атома с помощью квантовой механики.
Связь между электросферой и атомной структурой
Как уже отмечалось, электросфера охватывает область атома, в которой могут находиться электроны. В частности, электроны расположены на атомных орбиталях, энергия которых определяется квантовыми расчетами.
Электросфера – самая большая область атомного строения., поскольку ядро атома очень мало. Если рассматривать атом как футбольный стадион, то ядро будет соответствовать мячу в центре поля, а остальная часть стадиона будет электросферой.
Тем не менее, с точки зрения массы, электросфера вносит небольшой вклад.. Поскольку масса электронов примерно в 1836 раз меньше массы протонов и нейтронов, можно сказать, что почти вся масса атома сосредоточена в ядре.
Решаемые упражнения на электросфере
Вопрос 1
(Facisb 2023) В модели атома водорода Бора электрон может занимать только определенные орбиты. Некоторые из этих орбит представлены на рисунке, где n относится к уровням энергии, которые электрон имеет на каждой орбите.
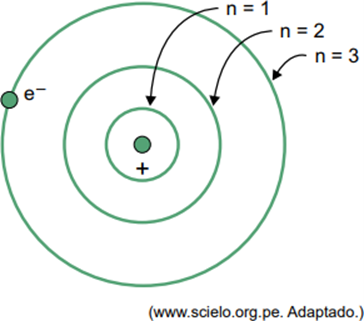
Учтите, что в атоме водорода электрон находится на орбите n = 5.
Согласно модели Бора, этот электрон будет излучать энергию в виде электромагнитного излучения только тогда, когда
(А) совершить переход на орбиту, на которой n равно 6.
(Б) остаются на орбите, где n = 5.
(C) переход на любую орбиту, на которой n больше 5.
(D) переход на любую орбиту, на которой n меньше 5.
(E) выбрасывается из атома, ионизируя его.
Ответ: буква Д.
Когда электрон находится во внешней оболочке, при возвращении во внутреннюю оболочку с меньшей энергией он выделяет избыточную энергию в виде электромагнитного излучения (света). Следовательно, появление света произойдет только тогда, когда электрон, присутствующий в n = 5, совершит переход на внутреннюю оболочку.
вопрос 2
(Uerj 2019) Недавно ученым удалось получить металлический водород путем сжатия молекулярного водорода под высоким давлением. Металлические свойства этого элемента такие же, как и у других элементов первой группы таблицы Менделеева.
Это сходство связано с наиболее энергетическим подуровнем этих элементов, которому соответствует:
(А) нс1
(Б) н.п.2
(С) нет3
(Д) нф4
Ответ: буква А.
Атом водорода имеет только один электрон, который находится на первом уровне, подуровне «s» (1s1). Одна из причин, по которой он находится в первой группе Периодической таблицы, заключается в том, что все остальные химические элементы в этой группе имеют атомы, валентная оболочка которых имеет тот же тип (ns1). Следовательно, благодаря аналогичному валентному слою водород удалось получить в этой металлической форме.
Источники:
ДО КАНТО, Э. Л.; ЛЕЙТ, Л. Л. В.; КАНТО, Л. В. Химия – в повседневной жизни. 1. ред. Сан-Паулу: Модерна, 2021.
Аткинс, П.; ДЖОНС, Л.; ЛАВЕРМАН, Л. Принципы химии: подвергать сомнению жизнь и окружающую среду. 7. ред. Порту-Алегри: Букман, 2018.
Аткинс, П.; ДЕ ПАУЛА, Дж.; КИЛЕР, Дж. Физическая химия Аткинса. 11 изд. Оксфорд: Издательство Оксфордского университета, 2018.
Хотели бы вы сослаться на этот текст в школьной или академической работе? Смотреть:
НОВАИС, Стефано Араужо. «Электросфера»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/eletrosfera.htm. Доступ осуществлен 10 ноября 2023 г.