THE теория октетов был предложен Ньютоном Льюисом, который в исследованиях заметил, что атомное взаимодействие происходит так что каждый элемент приобретает электронную стабильность благородного газа, то есть восемь электронов в валентный слой. Однако в некоторых молекулах происходит то, что называется расширением или сжатием октета, то есть центральный атом устанавливает более или менее предсказанные связи.
Читайте тоже: Ковалентная связь - классификации и характеристики
Как работает теория октетов?
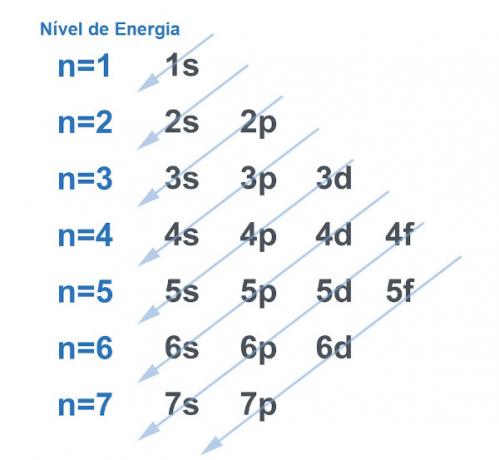
Конечно, все системы стремятся найти способ получить как можно больше стабильности, и с атомом дело обстоит так же. Атомы - это «базовые частицы» любой материи, и каждая из них имеет в своей структуре электросферу. Эта электросфера была разделена Линус Полинг на энергетических уровнях и подуровнях. Полинг разработал диаграмму, демонстрирующую, как будет выглядеть распределение электронов вокруг ядра атома.
См. Изображение ниже:
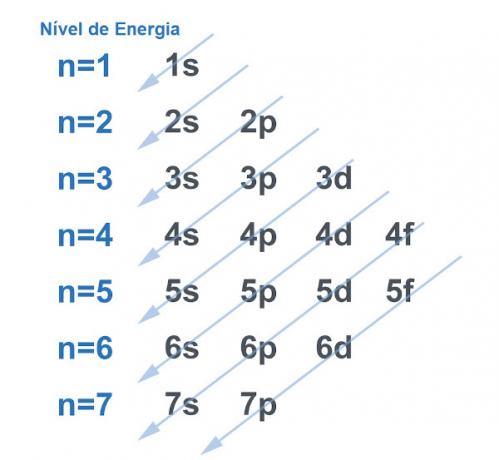
Каждый уровень и подуровень содержат электроны
. Проводя аналогию, можно сказать, что каждый уровень - это полка, а каждый подуровень - это ящик. В каждом ящике поместится по два электрона. Атом устойчив, когда все его электроны спарены, то есть когда есть все ящики с двумя электронами в каждом.Пример:
Давайте сделаем электронное распределение кислорода (O), который имеет восемь электронов в своем естественном состоянии.
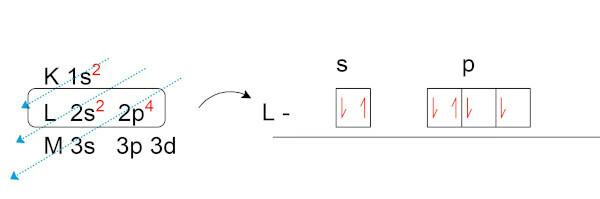
Обратите внимание, что в валентном слое (слой L на подуровне p) мы имеем два неспаренных электрона. Именно эти электроны устанавливают химические связи с другими элементами. желающие сформировать электронные пары.
Теория октетов основана на математике суммирования электронов. Если все подуровни последней электронной оболочки будут иметь по два электрона, валентная оболочка будет иметь всего восемь электронов и, следовательно, атом будет устойчивым.
Читайте тоже: Квантовые числа - числа, связанные с количеством энергии электрона.
благородные газы
Благородные газы - единственные элементы, которые можно найти в природе в одноатомной форме, то есть без установления связи с другим атомом. Это потому, что они обладают электронной стабильностью. Почти все они имеют восемь электронов на валентной оболочке., подчиняясь правилу октетов, за исключением газа гелия, который имеет только два электрона.

Исключения из теории октетов
Некоторым соединениям удается стабилизироваться с более или менее чем восемью электронами в валентной оболочке. В этих случаях случаются исключения из теории октетов.
расширение октета
Это происходит в основном с фосфором (P) и серой (S), которые являются относительно большими атомами и имеют подуровень «d». В этом случае атом содержит более восьми электронов в своей последней оболочке.
Пример:
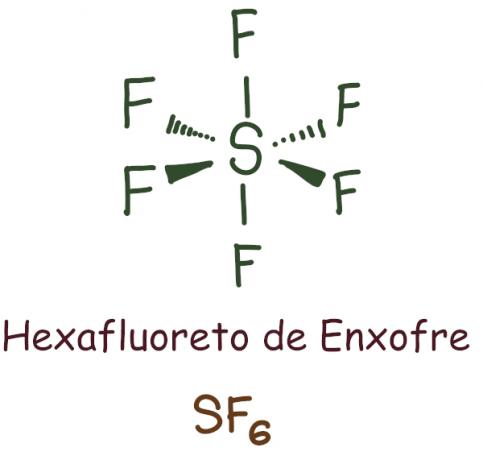
В случае гексафторида серы центральный элемент остался с 12 электронов, превышающие 8, необходимые для стабилизации в соответствии с правилом октетов. В этом случае произошло расширение октета.
сокращение октета
Бывает с бериллием (Be), бором (B) и некоторыми оксиды азота. См. Пример:
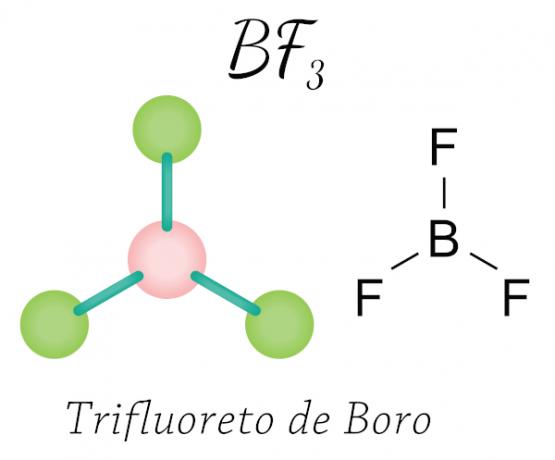
В случае трифторида бора атомы фтора приобретают необходимые восемь электронов в валентной оболочке, разделяя электронным с бором, соблюдая правило октетов, но центральный атом (бор) не стабилизируется шестью электронами, таким образом, происходит один сокращение октета.
Также доступ: Классификация сигма-ссылки: каковы критерии?
Решенные упражнения
Вопрос 1 - (Mackenzie-SP) Чтобы атомы серы и калия приобрели электронную конфигурацию, равную конфигурации благородного газа, необходимо, чтобы:
(Данные: атомный номер S = 16; К = 19.)
А) сера получает 2 электрона, а калий - 7 электронов.
Б) сера дает 6 электронов, а калий получает 7 электронов.
В) сера дает 2 электрона, а калий дает 1 электрон.
Г) сера получает 6 электронов, а калий отдает 1 электрон.
E) сера получает 2 электрона, а калий отдает 1 электрон.
разрешение
Альтернатива E. Сера является элементом колонки 16 или семейства 6А. Элементы этого семейства, как правило, получают два электрона с образованием электронных пар и имеют в общей сложности восемь электронов на валентной оболочке. Элементы семейства 1A, которые являются щелочными металлами, имеют только один электрон на валентной оболочке. Отдавая этот электрон, предыдущий слой становится валентным слоем, уже с восемью электронами, как это диктуется правилом октетов.
Вопрос 2 - Оцените следующие утверждения как истинные (T) или ложные (F).
I () Правило октетов гласит, что для стабильности атома в валентной оболочке необходимо восемь электронов.
II () Валентный слой - это второй электронный слой атома.
III () Хлор (Cl) из семейства галогенов имеет тенденцию приобретать два электрона для достижения стабильности.
IV () Натрий (Na), элемент семейства 1A, имеет тенденцию терять единственный электрон в своей валентной оболочке.
Отметьте правильный вариант:
А) I, III и IV верны.
Б) I и IV верны.
C) Верно только II.
D) Только IV неверен.
Д) Все верно.
разрешение
Альтернатива Б. I и IV верны. Утверждение II неверно, поскольку валентный слой является последним электронным слоем атома, а не вторым. И утверждение III говорит, что хлор имеет тенденцию получать два электрона, что не проверяет, так как хлор, будучи от 7A или 17, имеет тенденцию получать только один электрон, чтобы таким образом получить электронную конфигурацию газа. благородный.
Лайса Бернардес Маркес де Араужу
Учитель химии