Научитесь применять первый закон термодинамики в различных ситуациях, решайте упражнения и проверяйте свои знания с помощью решенных и объясненных упражнений.
Вопрос 1
Первый закон термодинамики гласит, что:
а) Энергия не может быть создана или уничтожена, но может быть преобразована из одной формы в другую.
б) Энергия всегда сохраняется, но не может быть преобразована из одной формы в другую.
в) Энергию можно создать или уничтожить, но нельзя преобразовать из одной формы в другую.
г) Энергия не может быть сохранена, но может быть преобразована из одной формы в другую.
Первый закон термодинамики – это закон сохранения энергии, поэтому в системе закрыты, количество энергии остается постоянным и может только переходить из одной формы в другую. другой.
вопрос 2
Предположим, что замкнутая система получает 100 Дж теплоты, совершая при этом 50 Дж работы. Как изменится внутренняя энергия системы?
а) -50 Дж
б) 0 Дж
в) 50 Дж
г) 100 Дж
д) 150 Дж
Проверка знаков:
Полученное тепло положительно Q > 0.
Совершенная работа положительна W > 0.
По первому закону имеем:
вопрос 3
Идеальная газовая система обменивается с внешней средой теплотой 500 Дж. Считая этот процесс изометрическим охлаждением, определить соответственно работу и внутреннюю энергию.
а) 500 Дж и 0 Дж
б) - 500 и 0 Дж
в) 0 Дж и 500 Дж
г) 0 Дж и - 500 Дж
д) -500 Дж и 500 Дж
Поскольку процесс изометричен, объем не меняется, поэтому работа равна нулю.
Согласно первому закону термодинамики:
Поскольку это охлаждение, система теряет тепло, поэтому:
вопрос 4
8 молей идеального газа в системе поршень-цилиндр сжимаются, совершая работу 1000 Дж. При этом во внешнюю среду теряется 400 Дж тепла. Его внутренняя энергия и изменение его температуры соответственно равны
Дано: R = 8,31 Дж/моль. К
а) - 1400 Дж и примерный разброс 6 К
б) 600 Дж и приблизительная вариация 6 К
в) 600 Дж и примерный разброс 14 К
г) - 1400 Дж и примерный разброс 14 К
внутренняя энергия
Так как система получает работу, ее знак отрицателен, как и теплота, которая при этом теряется.
Первый закон термодинамики:
Подставляя значения, получаем:
R = 8,31 Дж/моль·К
Температура
По закону Джоуля имеем:
вопрос 5
Совершенный газ сжимается, совершая работу 500 Дж. В конце этого превращения внутренняя энергия системы изменилась на 200 Дж меньше, чем в начале. Количество теплоты, переданное газом, было
а) - 700 Дж
б) - 300 Дж
в) 300 Дж
г) 0Дж
д) 700 Дж
Так как работа получена, то есть устойчивая работа, то ее знак отрицательный.
Подставив значения в уравнение первого закона термодинамики:
вопрос 6
(CEDERJ 2021) На этапе цикла, выполняемого идеальным газом в кондиционере, давление газа увеличивается, сохраняя его объем постоянным. На этой стадии цикла работа газа W, количество поглощенного им тепла Q и изменение его температуры ΔT равны соответственно:
а) W < 0, Q < 0 и ΔT < 0
б) W = 0, Q > 0 и ΔT > 0
в) W = 0, Q = 0 и ΔT = 0
г) W > 0, Q > 0 и ΔT > 0
Данные:
Давление P увеличивается;
Объем остается постоянным;
Работа
Поскольку объем постоянен, работа W равна нулю.
Первый закон термодинамики звучит так:
Поскольку теплота положительна, изменение внутренней энергии также будет положительным.
Нагревать
Поскольку теплота поглощается, она положительна.
Температура
По газовому закону:
Где,
n - количество молей
R - универсальная газовая постоянная
Таким образом, температура зависит только от давления, так как объем постоянен, будучи положительным.
вопрос 7
(UNICENTRO 2018) Согласно Первому закону термодинамики, изменение внутренней энергии системы, ΔU, равно определяется разницей между теплотой, обмененной с внешней средой, Q, и работой, W, выполненной в процессе термодинамический. С учетом этой информации, если одноатомный газ расширяется так, что всегда остается при одной и той же температуре, это превращение можно представить уравнением
а) ΔU + W = 0
б) ΔU − W =0
в) Q - W = 0
г) Q + ΔU = 0
Изотермический процесс протекает без изменения температуры.
Энергия связана с температурой следующим образом:
Где n — число молей, а R — универсальная газовая постоянная. Поскольку n и R постоянны, существует только изменение температуры, и
Первый закон термодинамики звучит так:
вопрос 8
(URCA 2016) Согласно первому закону термодинамики, если во время изотермического процесса с идеальным газом фиксированной массы газ высвобождает количество теплоты, величина которого равна 50 кал, то изменение внутренней энергии и работа, совершаемая газом в этом процессе, равны: соответственно:
а) 0 и 50 кал.
б) 50 кал и 0.
в) 0 и 0.
г) 50 кал и -50 кал.
д) 0 и -50 кал.
Изменение внутренней энергии прямо связано с изменением температуры. Поскольку процесс изотермический, изменение температуры не происходит, поэтому .
Из первого закона термодинамики:
Так как тепло выделяется, то его знак отрицательный.
вопрос 9
(UFRN 2012) Биомасса является одним из основных источников возобновляемой энергии, поэтому машины, использующие ее в качестве топлива для выработки электроэнергии, важны с экологической точки зрения. Очень распространенным примером является использование биомассы для привода паровой турбины для производства работы. На рисунке сбоку схематично показана упрощенная теплоэлектростанция.
В этой термоэлектрической установке сжигание биомассы в топке производит тепло, которое нагревает воду в котле и генерирует пар высокого давления. Пар, в свою очередь, по трубам подается к турбине, которая под его действием начинает вращать свои лопасти.
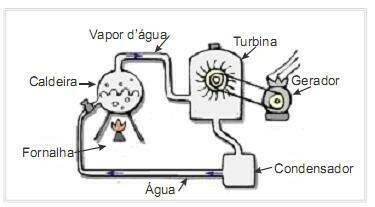
Потери тепла за счет перепада температур между частями этой тепловой машины и окружающей среды считать пренебрежимо малыми. При этом изменение внутренней энергии котловой воды
а) больше суммы тепла, подведенного к нему при сжигании биомассы, и работы, совершаемой на турбине.
б) равна сумме тепла, подводимого к нему при сжигании биомассы с работой, совершаемой на турбине.
в) равна разнице между теплом, подведенным к нему при сжигании биомассы, и работой, совершаемой на турбине.
г) больше, чем разница между теплом, подведенным к нему при сжигании биомассы, и работой, совершаемой на турбине.
Вода в котле получает энергию в виде тепла от сжигания топлива и высвобождает энергию в виде работы, совершаемой на турбине.
вопрос 10
(UECE 2021) Что касается свойств газов, обратите внимание на следующие утверждения:
я. Для идеального газа внутренняя энергия зависит только от давления.
II. Теплота, поглощаемая газом при изменении его состояния, не зависит от процесса.
III. Внутренняя энергия идеального газа зависит только от температуры и не зависит от процесса.
IV. При изотермическом расширении идеального газа работа, совершаемая им, равна поглощенной теплоте.
Правильно то, что сказано только в
а) I и II.
б) III и IV.
в) I и IV.
г) II и III.
III. ПРАВИЛЬНЫЙ. Внутренняя энергия идеального газа зависит только от температуры и не зависит от процесса.
Изменение внутренней энергии прямо связано с изменением температуры.
Где n — число молей, а R — постоянная идеального газа, так как они являются постоянными, только температура определяет внутреннюю энергию газа.
IV. ПРАВИЛЬНЫЙ. При изотермическом расширении идеального газа работа, совершаемая им, равна поглощенной теплоте.
Поскольку он изотермический, температура не меняется, поэтому изменение внутренней энергии равно нулю. По первому закону термодинамики:
Узнайте больше с помощью:
- Первый закон термодинамики
- Термодинамика: законы, понятия, формулы и упражнения
- Упражнения по термодинамике
- газовый закон
АСТ, Рафаэль. Упражнения по первому закону термодинамики.Все дело, [без даты]. Доступно в: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Доступ по адресу:
См. также
- Упражнения по термодинамике
- Термодинамика
- адиабатическое преобразование
- Упражнения по термохимии
- Первый закон термодинамики
- Естественные науки и их технологии: Энем
- Тепловая энергия
- Второй закон термодинамики