Кислотные оксиды - это оксиды, которые при реакции с водой образуют кислоту в качестве продукта. При реакции с основанием продукты будут солью и водой.
Эти соединения обычно имеют ковалентный характер, то есть они молекулярные, растворимы в воде и образованы в основном неметаллами, которые являются элементами с высокой электроотрицательностью. Когда они образованы металлами, они имеют высокую степень окисления (электрический заряд).
Примеры:
CO2, ТОЛЬКО2, ТОЛЬКО3, П2О5, Cl2О6, НА2, нет2О4, нет2О5, так далее.
Ниже приводится общая схема характерных реакций для кислотных оксидов и пример:
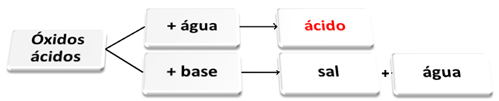
Кислотные оксиды, реагирующие с водой и основанием
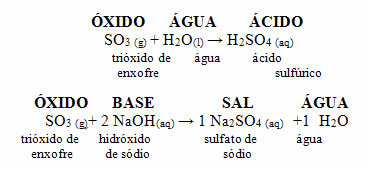
Кислотные оксиды еще называют ангидриды, потому что это слово происходит от греческого ангидрос, что значит "нет воды", а кислотные оксиды можно рассматривать как «безводную кислоту».
Свойства и применение некоторых кислотных оксидов:
• Двуокись углерода (двуокись углерода) - CO2:
Это соединение используется в качестве газа в безалкогольных напитках и минеральных водах, потому что под высоким давлением оно становится растворимым в воде. В этих продуктах образуется кислая среда, поскольку это кислый оксид, который реагирует с водой с образованием кислоты в соответствии с реакцией ниже:

При температуре ниже 78 ° C он находится в твердом состоянии и известен как сухой лед, который получил свое название, потому что его внешний вид напоминает лед. обычная, но не плавится, переходя в жидкое состояние при комнатной температуре, а переходит в паровое состояние, то есть возвышенное. Таким образом, эта функция используется как сценический ресурс на концертах, в кино, в театрах, на вечеринках и т. Д.

Углекислый газ - это кислотный оксид
Он также обнаруживается в атмосфере в результате дыхания человека, сжигания ископаемого топлива (угля, нефтепродуктов, алкоголя и т. Д.) И лесных пожаров. Таким образом, он один из виновников кислотных дождей.
• Оксиды серы - SO2 и другие3
Эти оксиды также присутствуют в атмосфере и имеют естественное и искусственное происхождение. Естественное происходит в результате извержений вулканов и разложения растений и животных. Искусственное соответствует наибольшему количеству этих оксидов в атмосфере, так как они удаляется при сжигании ископаемого топлива, в основном дизельного топлива, которое содержит серу, такую как примесь.
Диоксид серы (SO2) реагирует с кислородом из атмосферы с образованием триоксида серы (SO3). Когда этот последний оксид вступает в реакцию с дождевой водой, образуется серная кислота, очень сильная и вызывающая повреждения.
• Сжигание серы из топлива: S + O2 → ОС2
• Преобразование SO2 в SO3: SO2 + ½2 → ОС3
Реакции SO2 и SO3 с водой с образованием кислот: SO2 + H2O → H2ТОЛЬКО3
ТОЛЬКО3 + H2O → H2ТОЛЬКО4
• Тетроксиды диазота (азотно-азотный ангидрид) - N2О4
Это соединение имеет температуру кипения 22ºC, имеет желтый цвет и является довольно летучим. Он образуется в атмосфере в результате окисления азота и может быть в жидкой форме в виде димера диоксида азота или оксида азота (NO2). Выше этой температуры он принимает форму NO.2:
N2О4 ↔ НЕТ2
Это чрезвычайно токсичный газ, и его вдыхание смертельно. Он также используется в составе ракетного топлива.
Дженнифер Фогача
Окончила химический факультет
