Карбонаты - это неорганические соединения, образованные ионной связью металла или полуметалла с карбонат-анионом CO.32-.
Углерод четырехвалентен, то есть у него есть четыре электрона в валентной оболочке, и он может образовывать четыре ковалентные связи, чтобы быть стабильными, в то время как кислород является двухвалентным, имея шесть электронов в валентной оболочке и способный сделать две связи стабильными, с восемью электроны. Таким образом, углерод имеет сильную тенденцию связываться с двумя атомами кислорода, каждый из которых является стабильным (O = C = O → CO2).
Но другой кислород может соединяться с углеродом, так как соотношение ионных радиусов приводит к координационному числу, равному 3, образуя структуру треугольный, в котором углерод находится в центре, образуя двойную связь с одним из атомов кислорода и две одинарные связи с двумя другими кислороды. В результате получается два избыточных электрона, поскольку эти два атома кислорода нестабильны, и каждый из них должен получать по одному электрону:
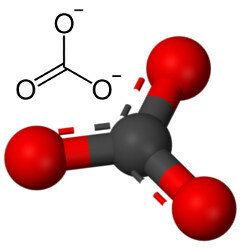
Карбонат-анион образован ковалентными связями, но его соединения, которые являются неорганическими солями и минералами известные как карбонаты, являются ионными, поскольку этот радикал получает два электрона от некоторого металла или полуметалла, образуя ионная связь.
Эти соединения нерастворимы в воде, за исключением карбоната аммония ((NH4)2CO3) и карбонаты, образованные щелочными металлами (элементы семейства 1: Li, Na, K, Rb, Cs и Fr). Почти все белые твердые тела, как показано на изображении ниже:

Двумя наиболее распространенными и наиболее важными примерами карбонатов в повседневной жизни являются карбонат натрия (Na2CO3) и карбонат кальция (CaCO3). В первом случае натрий принадлежит к семейству 1, имея электрон на валентной оболочке и стремящийся потерять этот электрон, чтобы стать стабильным. Поскольку карбонат-анион должен получить два электрона, он связывается с двумя атомами натрия:

Кальцинированная сода, более известная как сода или сода, используется в производстве мыла, красителей, лекарств, бумаги и для обработки воды в плавательных бассейнах. Но его основное применение - это карбонат кальция и песок при производстве стекла.
Кальций - это семейство 2, имеющее тенденцию терять два электрона. Таким образом, атом кальция связывается с карбонатным радикалом:

Карбонат кальция присутствует в известняке и мраморе. В сталактиты и сталагмиты те, что существуют в пещерах, состоят из этого карбоната; ракушки, коралловые рифы и яичная скорлупа. Когда мы белим стены, стволы деревьев и другие места, мы используем гидроксид кальция (Ca (OH)2), который со временем вступает в реакцию с атмосферным углекислым газом с образованием карбоната кальция.

Карбонаты очень распространены на поверхности земли, как и в случае минералов. Его кристаллический ретикулум может перестраиваться в пространстве двумя способами: орторомбическим (как в случае с минералом арагонитом, показанным выше вместе с формулой карбоната кальция) и ромбоэдрический или треугольный, как в случае кальцита (другого минерала, состоящего из карбоната кальция).
Карбонаты реагируют в присутствии кислот, выделяя CO.2, что хорошо видно по шипению.
Дженнифер Фогача
Окончила химический факультет
