НАШИ батарея представляет собой систему, в которой протекает окислительно-восстановительная реакция. В этом устройстве химическая энергия, образующаяся в результате самопроизвольной реакции, преобразуется в электрическую энергию.
В клетке одновременно протекают реакции окисления и восстановления. Когда один вид подвергается окислению, он отдает электроны другому виду, который, получив их, подвергается восстановлению.
Следовательно, тот, кто подвергается окислению, является восстановителем, а тот, кто подвергается восстановлению, является окислителем.
НАШИ окисление происходит, когда вид теряет электроны и становится катионом: A → A+ + и-.
НАШИ снижение происходит, когда вид получает электроны и становится электрически нейтральным: B+ + и- → Б.
В химических уравнениях это перенос электрона демонстрируется изменением степени окисления (nox).
Внутри клеток происходят восстановительные реакции и возникает электрический ток с миграцией электронов от отрицательного полюса к положительному.

Как работает стек?
Один окислительно-восстановительная реакция в общем случае можно представить уравнением:
А + Б+ → А+ + Б
Где,
A: вещество, которое окисляется, теряет электроны, увеличивает свою стоимость и является восстановителем.
B: вещество, которое подвергается восстановлению, получает электроны, снижает окисление и является окислителем.
Посмотрите на следующем изображении, как можно представить этот процесс.
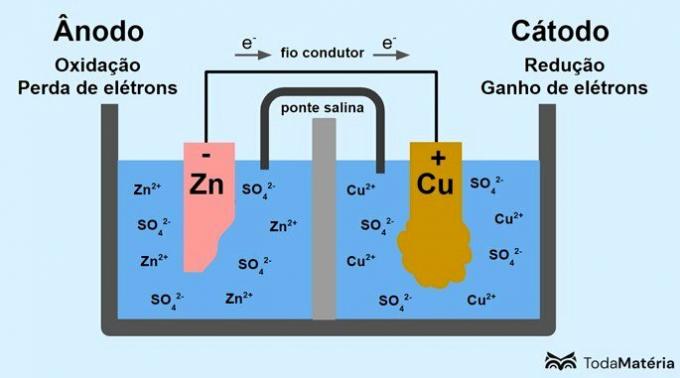
Система, разделенная на две полуэлементы и образованная двумя металлическими электродами, соединенными снаружи токопроводящей проволокой, была разработана Джоном Фредериком Даниэлем (1790-1845) в 1836 году.
Батарея состоит из двух электродов, соединенных токопроводящей проволокой, и электролита, в котором находятся ионы. Электрод представляет собой твердую проводящую поверхность, обеспечивающую обмен электронами.
анод: электрод, на котором происходит окисление. Это также отрицательный полюс батареи.
Катод: электрод, на котором происходит восстановление. Это также положительный полюс батареи.
На изображении выше металлический цинк является анодом и подвергается окисление. Металлическая медь является катодом и подвергается восстановлению. Миграция электронов (е-) происходит от анода к катоду через токопроводящую проволоку.
В системе образов происходят следующие реакции:
- анод (окисление): Zn(с) → цинк2(здесь) + 2е-
- Катод (уменьшение): Cu2+(здесь) + 2е- → жопа(с)
- общее уравнение: цинк(с) + жопа2+(здесь) → жопа(с) + цинк2+(здесь)
Цинк — металл с большей склонностью к потере электронов, поэтому в растворе образуются катионы. Цинковый электрод начинает изнашиваться и терять массу, так как цинк выделяется в раствор при образовании катионов Zn.2+.
Электроны от анода попадают на катод и катионы металлов, принимая их, превращаются в металлическую медь, которая осаждается на электроде и увеличивает его массу.
Солевой мостик — это ионный ток, отвечающий за циркуляцию ионов в системе, чтобы она оставалась электрически нейтральной.
Также читайте о степень окисления (nox).
типы батарей
В клетке склонность химических соединений получать или отдавать электроны определяется восстановительным потенциалом.
Компонент с наибольшим восстановительным потенциалом стремится к восстановлению, то есть к присоединению электронов. Частицы с самым низким потенциалом восстановления и, следовательно, с самым высоким потенциалом окисления склонны к переносу электронов.
Например, в окислительно-восстановительной реакции Zn0(с) + жопа2+(здесь) → жопа0(с) + цинк2+(здесь)
Цинк окисляется и отдает электроны, поскольку обладает восстановительным потенциалом E0 = -0,76В, меньше восстановительного потенциала меди E0 = +0,34В и, следовательно, получает электроны и подвергается восстановлению.
Ниже приведены другие примеры стеков.
Стек цинка и водорода
Полуреакция окисления: Zn(с) → цинк2+ + 2е- (А ТАКЖЕ0 = -0,76 В)
Полуреакция восстановления: 2H+(здесь) + 2е- → Н2(г) (А ТАКЖЕ0 =0,00 В)
Глобальное уравнение: Zn(с) + 2ч+(здесь) → цинк2+(здесь) + Н2(г)
Представление стека:
Медь и водородный элемент
Полуреакция окисления: H2(г) → 2ч+(здесь) + 2е- (А ТАКЖЕ0 = 0,00 В)
Полуреакция восстановления: Cu2+(здесь) + 2е- → жопа(с) (А ТАКЖЕ0 = +0,34 В)
Глобальное уравнение: Cu2+(здесь) + Н2(г) → 2ч+(здесь) + жопа(с)
Представление стека:
Получите больше знаний по теме с содержанием:
- электрохимия
- Электролиз
Библиографические ссылки
ФОНСЕКА, М. Р. М. Химия, 2. 1. изд. Сан-Паулу: Аттика, 2013.
САНТОС, WLP; МОЛ, Г.С. Гражданская химия, 3. 2. изд. Сан-Паулу: Editora AJS, 2013.
УБЕРКО, Дж. Соединить химия, 2: химия. - 2. изд. Сан-Паулу: Сарайва, 2014.



