В растворимостьможно определить как максимально возможное количество растворенного вещества, которое может быть растворено в определенном количестве растворителя при данной температуре.
Это максимальное количество, которое может быть растворено, также известно как коэффициент растворимости или степень растворимости. Но растворимость любого вещества зависит, среди прочего, от типа растворителя, в котором растворенное вещество диспергировано.
Например, NaCl (хлорид натрия - поваренная соль) хорошо растворяется в воде, и в 1 л воды при 20ºC мы можем растворить до 360 граммов этой соли. Но когда растворитель превращается в бензин при тех же условиях объема, температуры и давления, соль не растворяется.
Почему растворимость вещества так сильно варьируется от одного растворителя к другому?
Одним из факторов является полярность вовлеченных соединений. В приведенном примере мы видим, что соль полярна, вода полярна, а бензин неполярен. Соль образована атомами натрия (Na) и хлора (Cl), которые связаны ионными связями, в которых натрий определенно отдает электрон хлору, образуя ионы Na.
+ и Cl-. Поскольку эти ионы имеют противоположные заряды, они притягиваются и удерживаются вместе (Na+Cl-).
Это показывает нам, что соль действительно полярна, каждая ионная связь полярна, так как в соединении есть разница в электрическом заряде.
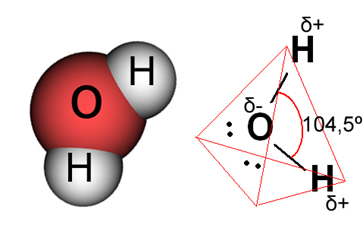
В случае воды существующая связь является ковалентной, в которой два атома водорода делят электроны с атомом кислорода. Молекула воды имеет два диполя, причем кислород имеет частично отрицательный заряд, а водород имеет частично положительный заряд (δ- О ─ H δ+). Но эти диполи не компенсируют друг друга, потому что молекула воды встречается под углом 104,5º, показывая, что распределение и заряд вдоль молекулы неоднородны. На атоме кислорода молекулы более высокая плотность отрицательного заряда. Это показывает нам, что молекула воды действительно полярна.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
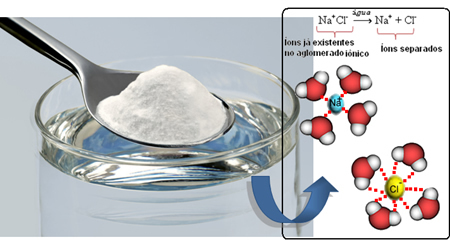
Итак, когда мы подмешиваем соль в воду, положительная часть соли - это катионы Na.+, притягивается отрицательная часть воды, то есть кислород, а отрицательная часть соли (анионы Cl-) притягивается положительной частью воды (H+). Следовательно, объединение Na+Cl- он разрушается, растворяя соль в воде.
Бензин, с другой стороны, состоит из смеси различных углеводородов, которые неполярны, то есть распределение электрического заряда бензина равномерно. Таким образом, не происходит взаимодействия ионов соли с бензином и он не растворяется.
Эти и другие подобные случаи приводят нас к следующему выводу:

Однако это нельзя считать общим правилом, так как во многих случаях неполярные растворенные вещества хорошо растворяются в полярных растворителях и наоборот. Итак, чтобы понять, почему это происходит, мы должны учитывать еще один фактор: тип межмолекулярная сила растворителя и растворенного вещества.
Закон об этом в тексте: "Связь между межмолекулярной прочностью и растворимостью веществ.”.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы ссылаться на этот текст в учебе или учебе? Смотреть:
FOGAÇA, Дженнифер Роча Варгас. «Взаимосвязь полярности и растворимости веществ»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. Доступ 27 июля 2021 г.