Буферный раствор это гомогенная смесь, которая не изменяет pH или pOH при добавлении к этой смеси небольших количеств сильной кислоты или сильного основания. Однако смесь не изменяет pH или pOH только в том случае, если она представляет собой один из двух приведенных ниже составов:
Затыкать кислота (pH менее 7):
Он содержит слабую кислоту, смешанную с поваренная соль растворимый, который имеет один и тот же анион, такой как синильная кислота (HCN) и цианид калия (KCN), которые имеют одинаковый цианид-анион (CN).
Основной буфер (pH больше 7):
База слабо смешивается с солью, имеющей такой же катион, такой как гидроксид цинка [Zn (OH)2] и хлорид цинка (ZnCl2), которые имеют одинаковый катион цинка (Zn+2).
Чтобы понять влияние буферного раствора на получение сильной кислоты или основания, важно помнить, когда кислоты и основания считаются сильными:
→ Рейтинг баз по прочности
сильный: основания с химическими элементами из семейств IA (щелочные металлы) и IIA (щелочноземельные металлы), за исключением магния;
слабый: основания, содержащие элемент магний и другой, если он не принадлежит к семействам IA и IIA.
→ Классификация кислота для силы
а) Для гидратов (бескислородных кислот):
сильный: только HCl, HBr и HI;
модерирует: Только ВЧ;
слабый: любой другой гидроксид.
б) Для оксикислот (кислот с кислородом):
сильный: когда вычитание количества атомов кислорода на количество атомов водорода равно или больше 2;
модерирует: когда вычитание количества атомов кислорода на количество атомов водорода равно 1;
слабый: когда вычитание количества атомов кислорода на количество атомов водорода равно или меньше 0.
Влияние добавления сильного основания в буфер
Для объяснения воспользуемся буферный раствор образуется гидроксидом цинка [Zn (OH)2] и растворимой солью хлорида цинка (ZnCl2), который получит небольшое количество сильного гидроксида натрия (NaOH). См. Остатки в этом буферном растворе:
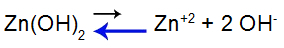
Уравнение равновесия диссоциации основания
Баланс смещается влево, потому что база слабая.
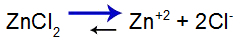
Уравнение равновесия диссоциации соли
Баланс смещается вправо, потому что соль растворима.
Сильная база имеет следующий баланс:
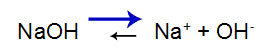
Уравнение равновесия диссоциации основания
Баланс смещается вправо, потому что основание крепкое.
Добавленное сильное основание высвобождает гидроксид-анион (ОН) в воду.-), который имеет высокое сродство к катионам цинка (Zn+2) от соли во втором равновесии. Связь между гидроксидом и цинком образует гидроксид цинка:
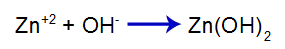
уравнение формирования основания
Итак, ОН- основания уменьшает количество цинка во втором равновесии и увеличивает количество основания [Zn (OH)2], вызывая его дальнейшую диссоциацию и высвобождение катионов Zn.+2 в первом равновесии. Поскольку мы не собираемся изменять количество гидроксида в среде, следовательно, pH не изменяется.
Влияние добавления сильной кислоты в буфер
Для объяснения воспользуемся буфером, образованным гидроксидом цинка [Zn (OH)2] и растворимой солью хлорида цинка (ZnCl2), который получит небольшое количество йодоводородной кислоты (HI), которая является сильной. Смотрите балансы присутствующие в шапке:
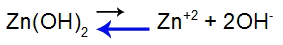
Уравнение равновесия диссоциации основания
Баланс смещен влево, потому что база слабая.
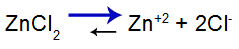
уравнение солевого баланса
Баланс сместился вправо, потому что соль растворима.
Сильная кислота имеет следующий баланс:
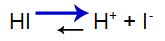
Уравнение кислотного баланса
Баланс сместился вправо, потому что кислота сильная.
Добавленная кислота производит катион гидроксония в воде (H+), который имеет высокое сродство к гидроксид-ионам (OH-) от базы. Связь между гидроксонием и гидроксидом образует молекулу воды:
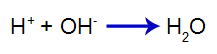
уравнение образования воды
Итак, H+ кислоты уменьшает количество гидроксидов в первом равновесии, увеличивая диссоциацию основания. Поскольку мы не собираемся изменять количество гидроксида в среде, следовательно, pH не изменяется.
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-solucao-tampao.htm

