Эксперименты - это практический способ изучить и проверить свои знания концепций, изучаемых в химии.
Воспользуйтесь этими химическими экспериментами, которые можно проводить дома (под присмотром взрослых) или поработать в классе с учителем, чтобы дополнить вашу учебу.
1-й опыт - распутывание красок
Задействованные концепции: хроматография и разделение смесей.
Материалы
- ручки (маркированные маркеры) разных цветов
- алкоголь
- фильтровальная бумага для кофе
- чашка (стакан для облегчения наблюдения за экспериментом)
Как сделать
- Ножницами нарежьте полоски фильтровальной бумаги. Для каждого используемого пера сделайте прямоугольник.
- Теперь на расстоянии примерно 2 см от основы нарисуйте круг выбранной вами цветной ручкой и раскрасьте всю внутреннюю часть.
- Приклейте край бумаги, наиболее удаленный от нарисованного мрамора, на подставку. Для этого можно использовать ленту и прикрепить ее к карандашу.
- Добавьте спирта в чашку, не слишком много, так как он должен касаться края бумаги рядом с отметкой ручки.
- Поместите бумагу в чашку так, чтобы она стояла вертикально. Карандаш, который поддерживает его, должен опираться на края.
- Подождите от 10 до 15 минут, чтобы спирт поднялся через фильтровальную бумагу. После этого удалите бумаги и дайте им высохнуть.
Результат
Когда спирт проходит через маркер пера, он взаимодействует с цветовыми компонентами и перемещает их по бумаге. Таким образом, различные пигменты будут разделены при контакте со спиртом.
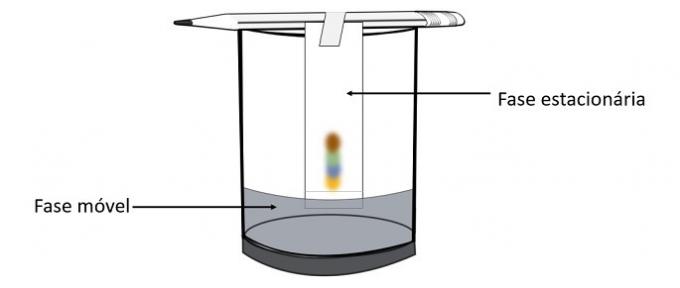
С помощью этого эксперимента можно узнать, какие цвета были смешаны для создания цвета пера.
Объяснение
Хроматография - это тип процесса разделения смесей. Фильтровальная бумага - это неподвижная фаза, а спирт - подвижная фаза, которая увлекает компоненты смеси при прохождении через неподвижную фазу. В этом процессе, чем сильнее взаимодействие со спиртом, тем быстрее пигмент будет перемещаться при прохождении растворителя.
Составляющие материала, поскольку они имеют разные свойства, будут взаимодействовать с подвижной фазой. по-разному, что можно заметить по разному времени сопротивления в стационарной фазе.
Узнать больше о хроматография.
2-й опыт - консервирование продуктов
Задействованные концепции: органические соединения и химические реакции.
Материалы
- яблоко, банан или груша
- лимонный или апельсиновый сок
- Таблетка витамина С
Как сделать
- Выберите один из трех фруктов и разрежьте его на 3 равные части.
- Первая часть послужит для сравнения с остальными. Так что ничего не добавляйте, просто оставьте на воздухе.
- В один из кусочков капните содержимое лимона или апельсина. Разложите так, чтобы вся внутренняя часть плода была покрыта соком.
- В последней части распределите витамин С, это может быть измельченная таблетка, по всей фруктовой мякоти.
- Посмотрите, что происходит, и сравните результаты.
Результат
Мякоть плодов, подвергшихся воздействию воздуха, должна быстро потемнеть. Лимонный или апельсиновый сок и витамин С, химическое вещество, называемое аскорбиновой кислотой, должны замедлить потемнение фруктов.

Объяснение
Когда мы разрезаем плод, его клетки повреждаются, высвобождая ферменты, такие как полифенолоксидаза, которые в контакт с воздухом окисляет фенольные соединения, присутствующие в пище, и вызывает ферментативное потемнение.
Чтобы предотвратить действие кислорода, используются консерванты, такие как аскорбиновая кислота, поскольку они предпочтительно окисляются вместо фенольных соединений. В дополнение к таблетке витамина С аскорбиновая кислота также присутствует в природных источниках, таких как цитрусовые, лимон и апельсин, предложенные в эксперименте.
Узнать больше о окисление.
3-й опыт - кто быстрее замерзает?
Задействованные концепции: коллигативные свойства и криоскопия
Материалы
- две трубки (используются для вечеринок)
- Стеклянная чаша
- столовая соль
- фильтрованная вода
- лед
- термометр
Как сделать
- Добавьте одинаковое количество фильтрованной воды в обе пробирки. Например, по 5 мл в каждой пробирке.
- Добавьте поваренную соль в одну из пробирок и прикрепите идентификационную ленту, чтобы отличить, какая из них соленая.
- Наполните стеклянную емкость колотым льдом и посолите.
- Одновременно поместите две пробирки внутрь льда и посмотрите, что произойдет.
- Запишите температуру замерзания для каждой ситуации.
Результат
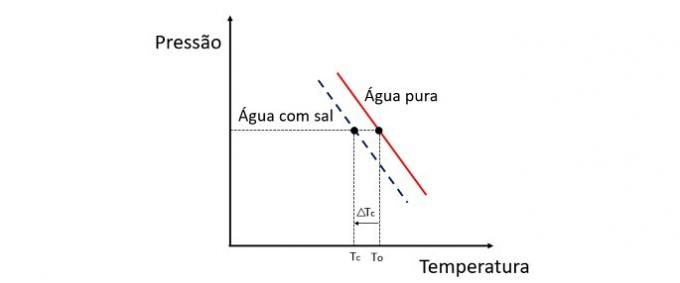
Добавление растворенного вещества в воду снижает температуру замерзания. Следовательно, обычная вода имеет тенденцию замерзать намного быстрее, чем раствор соли и воды при воздействии тех же условий.
Объяснение
Криоскопия - это комплексное свойство, которое изучает изменение температуры растворителя при растворении в нем различных количеств растворенного вещества.
Снижение температуры замерзания воды вызвано нелетучим растворенным веществом, и это явление имеет множество практических применений. Следовательно, большая концентрация растворенного вещества в растворе влияет на криоскопический эффект.
Если, например, вода замерзнет при 0 ° C и мы добавим в нее соль, температура фазового перехода будет отрицательной, то есть намного ниже.
Поэтому морская вода не замерзает в местах с температурой ниже 0 ° C. Соль, растворенная в воде, имеет тенденцию еще больше понижать температуру замерзания. В местах со снегом дороги также принято бросать солью, чтобы растопить лед и избежать несчастных случаев.
Узнать больше о коллигативные свойства.
4-й эксперимент - разложение перекиси водорода.
задействованные концепции: химическая реакция и катализатор
Материалы
- Половина сырого картофеля и половина приготовленного
- Кусок сырой печени и еще один приготовленный кусок
- Пероксид водорода
- 2 блюда
Как сделать
- В каждое блюдо добавить еду, вместе картофель и вместе печень.
- В каждый из четырех материалов добавляют по 3 капли перекиси водорода.
- Посмотрите, что происходит, и сравните результаты.
Результат
Перекись водорода, раствор перекиси водорода, при контакте с сырыми продуктами почти мгновенно начинает шипеть.
Этот эксперимент также можно провести, добавив кусок пищи в емкость с перекисью водорода, чтобы реакция была более заметной.
Объяснение
Шипучесть, создаваемая перекисью водорода при контакте с сырыми продуктами, характеризует возникновение химической реакции, которая представляет собой разложение перекиси водорода и выделение газа кислород.
Разложение перекиси водорода происходит под действием фермента каталазы, обнаруженного в органеллах пероксисом, присутствующих в клетках животных и растений.
Важно подчеркнуть, что разложение перекиси водорода происходит самопроизвольно, в присутствии солнечного света, но в очень медленной реакции. Однако каталаза действует как катализатор, увеличивая скорость химической реакции.
Перекись водорода может быть токсичным веществом для клеток. Таким образом, каталаза расщепляет соединение и производит воду и кислород, два вещества, которые не причиняют вреда организму.
При приготовлении пищи ее составные части претерпевают изменения. Модификации, вызванные приготовлением пищи, также ставят под угрозу действие каталазы, денатурируя белок.
То же действие, которое мы наблюдаем с едой, происходит, когда мы наносим перекись водорода на рану. Каталаза действует и происходит образование пузырьков, которые заключаются в выделении кислорода.
Узнать больше о химические реакции.
Библиографические ссылки
СВЯТЫЕ, В. Л. П.; МОЛ, Г. С. (Координаты.) Гражданская химия. 1. изд. Сан-Паулу: Новое поколение, 2011. v. 1, 2, 3.
БРАЗИЛИЙСКОЕ ХИМИЧЕСКОЕ ОБЩЕСТВО (орг.) 2010. Химия рядом с вами: недорогие эксперименты для класса K-12. 1. изд. Сан-Паулу.