Раствор и растворитель - это два компонента гомогенной смеси, называемой химическим раствором.
- Растворенное вещество: вещество, диспергированное в растворителе. Он соответствует веществу, которое будет растворяться, и, как правило, присутствует в растворе в меньшем количестве.
- Растворитель: это вещество, в котором растворенное вещество будет растворено с образованием нового продукта. В растворе он присутствует в большем количестве.
Растворение растворенного вещества (диспергированного) и растворителя (диспергатора) происходит за счет взаимодействия между их молекулами.
Разница между этими двумя компонентами раствора заключается в том, что растворенное вещество - это вещество, которое будет растворяться, а растворитель - это вещество, которое будет влиять на растворение.
Самый известный растворитель - вода, универсальный растворитель. Это потому, что он обладает способностью растворять большое количество веществ.
Растворители и примеры растворителей
Посмотрите несколько примеров химических растворов и узнайте о растворенных веществах и растворителях каждого из них:
Вода и соль
- Растворенное вещество: поваренная соль - хлорид натрия (NaCl).
- Растворитель: вода
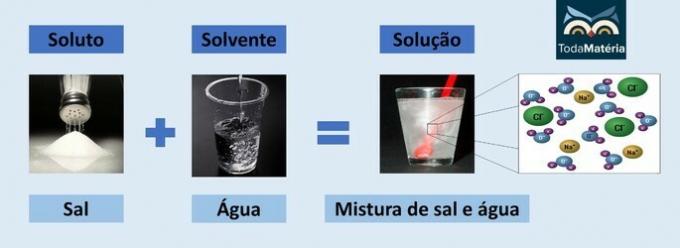
Поскольку это ионное соединение, хлорид натрия в растворе диссоциирует и образует ионы, которые, в свою очередь, сольватируются молекулами Воды.
Положительный полюс воды (H+) взаимодействует с анионом соли (Cl-) и отрицательный полюс воды (O2-) взаимодействует с катионом (Na+).
Это тип электролитического раствора, поскольку ионные частицы в растворе способны проводить электрический ток.
вода и сахар
- Растворенное вещество: сахар - сахароза (C12ЧАС22О11)
- Растворитель: вода

Сахар - это ковалентное соединение, и при растворении в воде молекулы они расходятся, но не меняют своей личности.
Этот водный раствор классифицируется как неэлектролитический, поскольку растворенное вещество, диспергированное в растворе, является нейтральным и, следовательно, не реагирует с водой.
Уксус
- Растворенное вещество: уксусная кислота (CH3COOH)
- Растворитель: вода

Уксус - это раствор, содержащий не менее 4% уксусной кислоты, карбоновая кислота который, будучи полярным, взаимодействует с водой, также полярной, через водородные связи.
Важное правило растворимости - подобное растворяется в подобном. Полярные соединения растворяются в полярных растворителях, а неполярные вещества растворяются в неполярных растворителях.
Другие решения
Помимо жидких растворов, существуют также газообразные и твердые растворы.
Воздух, которым мы дышим, является примером газообразного раствора, в котором больше газов: азот (78%) и кислород (21%).
В металлические сплавы они твердые растворы. Например, латунь (цинк и медь) - это смесь, из которой делают музыкальные инструменты.
Хотите получить больше знаний? Так что прочтите эти другие тексты:
- Химические Растворы
- межмолекулярные силы
- Однородные и гетерогенные смеси
Что такое коэффициент растворимости?
Коэффициент растворимости - это предел растворенного вещества, добавляемого к растворителю при данной температуре с образованием насыщенного раствора.
О коэффициент растворимости варьируется в зависимости от условий и может увеличиваться или уменьшаться в зависимости от изменений температуры и рассматриваемого растворенного вещества.
Существует предел, до которого растворитель может растворяться.
Пример: Если вы положите сахар в стакан с водой, в первый момент вы заметите, что сахар исчезает в воде.
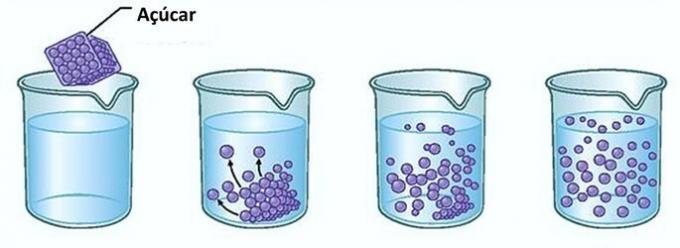
Однако, если вы продолжите добавлять сахар, вы обнаружите, что в какой-то момент он начнет накапливаться на дне стакана.
Это потому, что вода, которая является растворителем, достигла предела растворимость и максимальное количество концентрации. Растворенное вещество, которое остается на дне контейнера и не растворяется, называется фон тело.
Избыток сахара на дне стакана не растворяется и не влияет на концентрацию раствора. Кроме того, сахар, осевший на дне стакана, не сделает воду слаще.
Классификация решений
Растворы можно классифицировать по количеству растворенного вещества. Таким образом, они могут быть трех типов: насыщенные, ненасыщенные и перенасыщенные.
- насыщенный раствор: Раствор достиг предела коэффициента растворимости, то есть существует максимальное количество растворенного вещества, растворенного в растворителе при определенной температуре.
- ненасыщенный раствор: Количество растворенного вещества еще не достигло коэффициента растворимости. Это означает, что можно добавить больше растворенного вещества.
- перенасыщенный раствор: Растворенного вещества больше, чем в обычных условиях. В этом случае они представляют собой осадок.
Чтобы узнать больше о решениях, прочтите следующие тексты.:
- Разбавление растворов
- Моляльность
- Молярность
- Титрование
Концентрация растворов
По растворенному веществу и растворителю можно рассчитать концентрацию раствора.
Обычная концентрация определяется как отношение массы растворенного вещества, растворенного в данном объеме раствора.
Расчет концентрации производится по следующей формуле:
Существование,
Ç: Концентрация (г / л);
м: масса растворенного вещества (г);
V: объем раствора (л).
Пример:
(Faap) Рассчитайте концентрацию в г / л водного раствора нитрата натрия, содержащего 30 г соли в 400 мл раствора:
разрешение:
Обратите внимание на информацию о количестве растворенного вещества и растворителя. В 400 мл водного раствора (растворителя) содержится 30 г соли (растворенного вещества).
Однако объем указан в мл, и нам нужно преобразовать его в L:
Теперь, чтобы узнать концентрацию, вам просто нужно применить формулу:
С этим результатом мы пришли к выводу, что при смешивании 30 г соли с 400 мл воды мы получим раствор с концентрацией 75 г / л.
Эти тексты будут полезны для получения дополнительной информации о том, как рассчитать общую концентрацию.:
- Концентрация раствора
- Упражнения на общую концентрацию