Когда два раствора смешиваются, независимо от того, разные они или нет, необходимо сначала проанализировать, есть ли между ними реакция. Например, если смешать раствор воды с сахаром (водный раствор сахарозы) с раствором воды с солью (рассол), мы получим смешивание растворов без химических реакций.
То же самое происходит, если мы смешиваем два раствора хлорида натрия (NaCl) с разными концентрациями. В этом случае реакции тоже не будет. Затем мы можем определить этот пример как смешивание растворов одного и того же растворенного вещества без каких-либо химических реакций, где первый пример - это смешивание растворов различных растворенных веществ без химической реакции.
В обоих случаях химический состав компонентов растворов не изменится.Однако некоторые количественные аспекты придется пересчитать.
Чтобы понять, как можно определить молярную концентрацию (молярность) и обычную концентрацию смеси растворов без реакции, давайте посмотрим, как разрешаются два упомянутых случая:
1) Смесь растворов одного и того же растворенного вещества без возникновения химической реакции:

Представьте, что мы смешиваем два раствора хлорида натрия: один с концентрацией 2,0 г / л в 60,0 мл раствора, а другой с концентрацией 2,5 г / л в объеме раствора 80 мл.
Поскольку реакции не происходит, масса и объем являются просто суммой начальных масс и объемов:
m (раствор) = m1 (NaCl) + м2 (NaCl)
м1 (NaCl) = v. См2 (NaCl) = v. Ç
м1 (NaCl) = 0,06 л. 2,0 г / л м2 (NaCl) = 0,08 л. 2,5 г / л
м1 (NaCl) = 0,1 г2 (NaCl) = 0,2 г
м (раствор) = 0,1 г + 0,2 г
м (раствор) = 0,3 г
v (решение) = v1 (NaCl) + v2 (NaCl)
v (раствор) = (60 + 80) мл
v (раствор) = 140 мл = 0,14 л
Затем можно получить концентрацию, используя эти данные:
C (раствор) = м (раствор)
v (решение)
C (раствор) = 0,3 г
0,14 л
C (раствор)≈ 2,14 г / л
2) Смесь различных растворов растворенных веществ без возникновения химической реакции:
Возьмем, например, смесь 500 мл водного раствора сахарозы (C12ЧАС22О11), который изначально имел концентрацию 18,0 г / л, с 1 л водно-солевого раствора (водный раствор хлорида натрия - NaCl) с концентрацией 100,0 г / л.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
После смешивания, каковы были молярность, обычная концентрация, масса и объем раствора, полученного в результате смешивания?
Поскольку химической реакции не было, массы C12ЧАС22О11 и NaCl остаются без изменений. И начальные значения массы могут быть достигнуты по простому правилу трех с использованием реакционных концентраций.
18,0 г 1 л
м (C12H22O11) 0,5 л
м (С12ЧАС22О11) = 9,0 г
м (NaCl) 100,0 грамм
Масса также может быть достигнута по формуле:
м = v. Ç
м (С12ЧАС22О11) = 0,5 л. 18 г / л
м (С12ЧАС22О11) = 9,0 г
m (NaCl) = 1 л. 100,0 г / л
m (NaCl) = 100,0 г
Таким образом, общая масса раствора складывается из двух масс:
m (раствор) = m (C12ЧАС22О11) + m (NaCl)
м (раствор) = 109,0 г
Объем - это просто сумма начальных объемов, поэтому мы имеем:
v (окончательное решение) = v (C12ЧАС22О11) + v (NaCl)
v (окончательное решение) = (0,5 + 1) л
v (окончательный раствор) = 1,5 л
Конечная концентрация достигается путем отдельного расчета концентраций каждого из растворенных веществ. Поскольку они не взаимодействуют друг с другом и их массы не меняются, мы можем использовать следующую формулу концентрации:
C = м
v
начальная = мисходный окончательный c = mФинал
vисходный vФинал
мисходный = мФинал
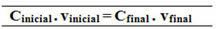
C (C12ЧАС22О11) =?
Çисходный. vисходный = CФинал. vФинал
18,0 г / л. 0,5 л = СФинал .1,5 л
C (C12ЧАС22О11) Финал = 6,0 г / л
С (NaCl) =?
Çисходный. vисходный = CФинал. vФинал
100,0 г / л. 1 л = Cконч. 1,5 л
С (NaCl)Финал = 66,67 г / л
Связь, сделанная для этой формулы общей концентрации, также может быть использована для расчета молярности (Mя. vя = Mж. vж) и для массовой концентрации (Название - Тя. vя = Tж. vж).
Дженнифер Фогача
Окончила химический факультет


