Окись углерода - это бесцветный, легковоспламеняющийся и токсичный газ без запаха.
Его молекулярная формула CO. Он состоит из молекулы углерода и кислорода.
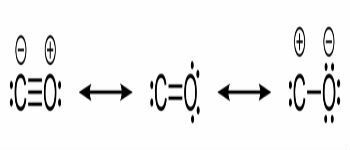
Структурные формулы оксида углерода и химических связей между углеродом и кислородом
Он возникает двумя способами:
- Естественные источники вещания: активность вулканов, природный газ и электрические разряды.
- Деятельность человека: Результат горение неполное ископаемое топливо. Сжигание производит тонны CO, являясь одним из основных видов выбросов CO в атмосферу.
Функции
Окись углерода относится к группе оксиды. Классифицируется как нейтральный оксид, образованные металлом плюс кислород. Кроме того, он не реагирует с водой, кислотами и основаниями.
Он используется в качестве восстановителя, он удаляет кислород из соединения и производит углекислый газ (CO2). Поэтому его использование при переработке руд, таких как железо, очень распространено. А также в производстве органических веществ, таких как уксусная кислота, пластмассы, метанол и другие.
При взаимодействии с кислородом воздуха образуется углекислый газ. По следующей химической реакции: 2 СО + О2 → 2 СО2
В поверхностных водах высокая концентрация окиси углерода служит источником энергии для микроорганизмов.
Окись углерода - один из газов парниковый эффект. Его концентрация в атмосфере способствует большему удержанию тепла. Поэтому он считается загрязняющим газом.
Интоксикация
CO имеет высокое сродство к гемоглобину. Поскольку он токсичен, его вдыхание оказывает воздействие на здоровье человека и даже может привести к смерти.
Поскольку CO не имеет запаха, его можно незаметно вдохнуть. Поэтому в некоторых случаях человеку требуется много времени, чтобы заметить опьянение.
При вдыхании в низкой концентрации он вызывает мигрень, замедленное мышление, раздражение глаз и потерю мануальных навыков. В высоких концентрациях он может вызвать судороги, потерю сознания и даже смерть от удушья.
Но как бывает опьянение?
В гемоглобин соединяется, конечно, с O2 и переносит его в ткани тела. Однако сродство между CO и гемоглобином намного больше, примерно в 250 раз больше, чем с O2.
В присутствии CO гемоглобин связывается с ним, препятствуя транспортировке кислорода к клеткам. Комбинация CO с гемоглобином дает карбоксигемоглобин.
Основные причины отравления СО возникают в следующих ситуациях:
- Двигатели автомобилей, работающие в закрытых помещениях;
- Ожог натуральный газ в неэффективных обогревателях;
- Отвод газов из кухни или дровяной печи в плохо вентилируемых помещениях.
В странах с холодным климатом дома, как правило, дольше остаются закрытыми и используют системы отопления. Чтобы избежать газовых аварий, все чаще используются детекторы CO.
Узнать больше, читайте также:
- Углеродный цикл
- Углерод
- Ископаемое топливо
- Кислород