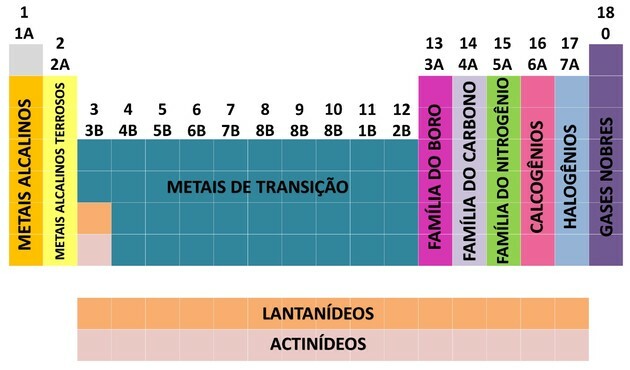
Один из способов организации химических элементов - через семейства, которые соответствуют вертикальным последовательностям периодической таблицы.
В 18 столбцов В таблице элементы сгруппированы по сходству в химических свойствах.
Организация химических элементов по семействам была практическим способом структурирования различной найденной информации и ее простого представления.
Чтобы облегчить определение местоположения химического элемента, семейства были обозначены номерами от 1 до 18 следующим образом:
Благодаря вкладу многих ученых и различным попыткам систематизировать данные, таблица Менделеева эволюционировала, установив порядок расположения элементов.
Номенклатура семейств
- Семейства в таблице были разделены на A (репрезентативные) и B (переходные), обозначенные буквами и цифрами.
- Ты репрезентативные элементы семейства 0, 1A, 2A, 3A, 4A, 5A, 6A и 7A соответствуют.
- Ты переходные элементы семейства 1B, 2B, 3B, 4B, 5B, 6B, 7B и 8B соответствуют друг другу.
- По определению Международного союза теоретической и прикладной химии (IUPAC), семьи были идентифицированы в группы от 1 до 18.
Периодическая таблица и электронное распространение
Сходство между элементами одного семейства происходит потому, что количество валентных электронов атома в основном состоянии одинаково для членов определенной группы.
Например:
| Группа 1 | Электронная раздача |
|---|---|
| 3читать | 2-1 |
| 11В | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Руб. | 2-8-18-8-1 |
| 55CS | 2-8-18-18-8-1 |
| 87Пт | 2-8-18-32-18-8-1 |
Атомы группы 1 имеют свои электроны, распределенные более чем на одном энергетическом уровне, но все они имеют валентный электрон.
При этом мы видим, что создание электронное распределение атома в основном состоянии, мы находим его положение в периодической таблице.
репрезентативные элементы
Типичные элементы демонстрируют относительно менее сложное химическое поведение, чем переходные элементы, и образуют большинство веществ вокруг нас.
Некоторым из репрезентативных семейств элементов даны специальные имена, как показано ниже:
Группа |
Семья | конкретное имя | Происхождение имени | Элементы | электронная конфигурация |
|---|---|---|---|---|---|
| 1 | 1А | щелочные металлы | с латыни щелочь, что означает «серый цвет растений». | Li, Na, K, Rb, Cs и Fr | нас1 |
| 2 | 2А | щелочноземельные металлы | Термин «земной» относится к «существующему на земле». | Be, Mg, Ca, Sr, Ba и Ra | нас2 |
| 13 | 3А | семейство бора | Имя первого элемента семейства. | B, Al, Ga, In, Tl и Nh. | нас2нп1 |
| 14 | 4А | углеродная семья | Имя первого элемента семейства. | C, Si, Ge, Sn, Pb и Fl. | нас2нп2 |
| 15 | 5А | Семья азота | Имя первого элемента семейства. | N, P, As, Sb, Bi и Mc. | нас2нп3 |
| 16 | 6А | Халькогены | из греческого халк поскольку они являются элементами, обнаруженными в медных рудах. | O, S, Se, Te, Po и Lv. | нас2нп4 |
| 17 | 7А | Галогены | Греческое выражение, означающее солеобразователи. | F, Cl, Br, I, At и Ts. | нас2нп5 |
| 18 | 0 | Благородные газы | Считалось, что с другими веществами не вступает в реакцию. | Он, Ne, Ar, Kr, Xe, Re и Og. | 1 с2 (Он) или мы2нп6 |
Через таблицу мы видим, что:
- Представленные выше элементы классифицируются как репрезентативные, поскольку они имеют наиболее энергичный электрон на s- или p-подуровне.
- Электроны распределены по энергетическим уровням, а n представляет собой самый внешний уровень атома в основном состоянии.
- Репрезентативные элементы, согласно рекомендации IUPAC, принадлежат к группам или семействам 1,2,13,14,15,16,17 и 18.
О водород он классифицируется отдельно от других элементов. Даже с электронной конфигурацией 1с1, он не принадлежит к группе 1 из-за необычного поведения.
переходные элементы
Переходные элементы соответствуют группам с 3 по 12. Они получили это название, потому что имеют промежуточные характеристики между группами 1 и 2 и типичными неметаллическими элементами.
Ты переходные металлы определены IUPAC как:
Переходный элемент имеет неполный подуровень d или может образовывать катионы с неполным подуровнем d.
Когда наиболее энергичный электрон атома в основном состоянии находится на неполном d-подуровне, это характеризуется как внешний переход.
Лантаноиды и актиниды являются внутренними переходными элементами, поскольку имеют по крайней мере один неполный f подуровень.
Когда у элементов есть электроны, которые заполняют d- или f-орбитали, они проявляют аналогичные свойства и могут быть классифицированы на d- или f-орбитальные элементы. внешний или внутренний переход.
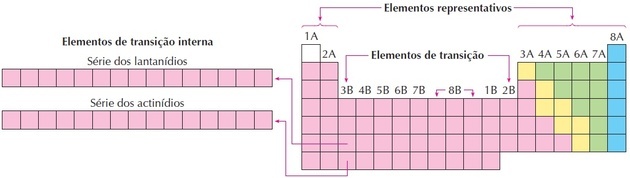
Как мы видим на изображении, семейство 8B соответствует 3 столбцам, это группы 8, 9 и 10, которые были сгруппированы таким образом, потому что они имеют схожие характеристики.
Основные характеристики семей
В таблице ниже показаны основные свойства групп в периодической таблице:
| Группа | Функции | сложные вещества чаще |
происшествия |
|---|---|---|---|
| 1 | Твердая и блестящая в окружающих условиях. Очень реактивные, мягкие и хорошие проводники электричества. | Соли, гидроксиды и оксиды |
Реагируют с галогенами и образуют соли. |
| 2 | Менее реактивен и сложнее, чем группа 1. Серебряные твердые частицы с хорошей проводимостью. | Соли, гидроксиды и оксиды |
Образует соли и оксиды. |
| От 3 до 12 | Они образуют комплексы. Это твердые и хрупкие металлические вещества, за исключением ртути, которая является жидкостью. | Соли, оксиды и комплексы. Пример: AgNO3, TiO и [Cr (OH)3(ЧАС2O)3] |
В минералах в виде оксидов. |
| 13 | Твердые вещества в окружающих условиях, серебро, кроме бора. | Оксиды Пример: B2О3 |
В минералах в виде оксидов. |
| 14 | Твердый в окружающих условиях. | Атомы C и Si могут располагаться в цепочки и давать огромное количество различных веществ. | В живых организмах и в виде силикатов или оксидов. |
| 15 | Твердые вещества, кроме азота, который в условиях окружающей среды является газообразным. | Оксиды и кислоты Пример: НЕТ2 и H3ПЫЛЬ4 |
Атмосфера, живые организмы и минералы. |
| 16 | Твердые вещества, кроме кислорода, который в условиях окружающей среды является газообразным. | Сульфиды и оксиды Пример: ZnS и SiO.2 |
Атмосфера, живые организмы и минералы. |
| 17 | Они образуют двухатомные молекулы и очень реактивны. Они плохие проводники электричества и тепла. Они агрессивны по отношению к живым существам и окружающей среде. | Кислоты и соли. Пример: HCl и KBr |
Присутствуют в веществах органические и минеральные. |
| 18 | Они очень стабильны и находятся в виде газов. | Они практически не образуют сложных веществ. | Газы в атмосфере. |
Химические и физические свойства отличают одно семейство от другого. Как мы видели, химические свойства связаны с электроны валентности, и через них один атом взаимодействует с другим, отвечая за химическое поведение и химические связи сформирован.
Физические свойства элементов одной группы могут варьироваться в зависимости от атомного номера и массы.
Упражнения
Теперь, когда вы знаете немного больше о семействах периодической таблицы, проверьте свои знания и посмотрите, что вы узнали.
1) Рассмотрим следующий отрывок из Периодической таблицы.
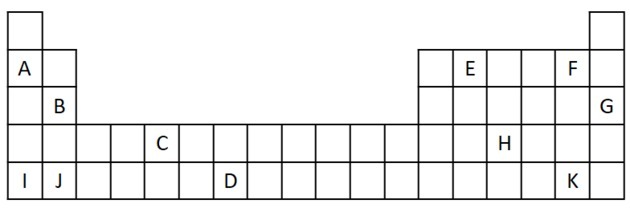
а) Назовите два элемента, у которых есть два валентных электрона.
б) Укажите элемент, который бурно реагирует с водой с образованием гидроксида металла.
c) Укажите нереактивный элемент.
г) Укажите два элемента, которые соединяются с щелочными металлами с образованием солей.
Отвечать:
а) B и J
Два валентных электрона соответствуют группе 2, которая имеет ns-электронную конфигурацию.2 и представлены в упражнении B и J.
б) A, B, I или J.
A и I представляют элементы семейства 1; B и J из семьи 2. Как мы видели в таблице свойств, элементы групп 1 и 2 очень реакционноспособны и могут образовывать гидроксиды, как в приведенных примерах: КОН и Mg (OH).2.
в) G
Благородные газы очень стабильны и поэтому не обладают высокой реакционной способностью. Буква G вставлена в таблицу как элемент этого семейства.
г) F и K
Галогены реагируют с щелочными металлами с образованием солей. Самый распространенный пример - поваренная соль NaCl.
2) На следующем рисунке слева направо показаны три химических элемента: литий, натрий и калий.

Выберите вариант, который правильно завершает каждое из следующих утверждений.
1.1) «Можно сказать, что литий, натрий и калий ...
(A)… принадлежат к тому же периоду ».
(B)… имеет тот же атомный номер ».
(C)… принадлежат к той же группе ».
(D)… имеет такое же массовое число ».
1.2) «Элементы литий, натрий и калий ...
(A)… имеет очень похожие химические свойства ».
(B)… имеет очень разные химические свойства ».
(C)… неметаллы ».
(D)… реагировать с водой с образованием кислых растворов ».
Ответы:
1.1) (C) принадлежат к той же группе.
1.2) (A) имеет очень похожие химические свойства.
Мы можем получить эту информацию, проконсультировавшись с периодической таблицей или сделав электронное распределение элементов лития, натрия и калия. Мы увидим, что у всех троих есть электрон в валентной оболочке, и, поскольку они являются частью одной группы, химические свойства очень похожи.
3) Рассмотрим следующую таблицу, в которой представлены атомные номера и электронные распределения некоторых химических элементов.
| Элемент | химический символ | атомный номер | Электронная раздача |
|---|---|---|---|
| Литий | читать | 3 | 2,1 |
| Бериллий | быть | 4 | 2,2 |
| Фтор | F | 9 | 2,7 |
| неон | Хм | 10 | 2,8 |
| хлор | Cl | 17 | 2,8,7 |
| аргон | Воздуха | 18 | 2,8,8 |
| Калий | K | 19 | 2,8,8,1 |
| Кальций | Здесь | 20 | 2,8,8,2 |
Укажите группу каждого элемента.
Отвечать:
Литий и калий: группа 1. (У них есть электрон в валентной оболочке).
Бериллий и кальций: группа 2. (У них есть два электрона в валентной оболочке).
Фтор и хлор: группа 17. (У них семь электронов в валентной оболочке).
Неон и аргон: группа 18. (У них восемь электронов в валентной оболочке).
Проверьте вопросы вступительного экзамена с комментариями к разрешению Упражнения с периодической таблицей и неопубликованные вопросы по теме в Упражнения по организации периодической таблицы.



