Кислородные функции - это одна из 4 функциональных групп органических соединений. Соединения, которые принадлежат к этой функции, образованы кислородом, включая альдегиды, кетоны, карбоновые кислоты, сложные эфиры, простые эфиры, фенолы и спирты.
спирты
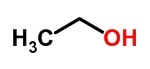
Ты спирты они образованы гидроксилами, связанными с атомами углерода, которые имеют только одинарные связи.
Спирты могут быть первичными, вторичными или третичными.
- Грунтовки когда присоединен только к одному атому углерода
- Вторичные при соединении с двумя атомами углерода
- высшее при присоединении к трем атомам углерода.
Основными спиртами являются этанол, присутствующий в алкогольных напитках и топливе, и метанол, который используется в качестве растворителя.
Его номенклатура соответствует IUPAC (Международный союз теоретической и прикладной химии, на португальском языке):
- префикс - количество атомов углерода
- промежуточный - тип химической связи
- суффикс - ol, алкоголя
сложные эфиры

Ты сложные эфиры очень похожи на карбоновые кислоты. Это потому, что единственное различие между ними состоит в том, что у сложных эфиров есть углеродный радикал, а у карбоновых кислот есть водород.
Эти органические соединения можно растворить только в спирте, эфире и хлороформе.
Сложные эфиры являются ароматизаторами, то есть они используются для ароматизации таких веществ, как сладости, соки и сиропы.
Название сложных эфиров образовано следующим образом:
- префикс указывает количество атомов углерода
- промежуточное звено указывает на тип химической связи
- добавляется суффикс -oato, как и элемент "from"
- следует за окончанием -ila
Альдегиды
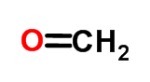
Ты альдегиды они состоят из алифатических или ароматических органических соединений. Они имеют карбонильный состав (двойной СO), который расположен на концах молекулярной структуры.
В качестве альдегидов, присутствующих в повседневной жизни, можно упомянуть дезинфицирующие средства, лекарства, пластификаторы, смолы и отдушки.
Основными из них являются метаналь (формальдегид), этаналь (ацетальдегид), пропаналь (пропионовый альдегид), бутаналь (бутиральдегид), пентаналь (валеральдегид), фенилметаналь (бензальдегид) и ванилин.
Согласно IUPAC, суффикс -al используется для обозначения соединений. Этот суффикс указывает на органическую функцию альдегидов.
Кетоны

В кетоны они состоят из углерода, соединенного двойной связью с кислородом, карбонилом, который находится в середине молекулы.
Кетоны могут быть симметричными (одинаковые радикалы) или асимметричными (разные радикалы).
Их классифицируют по количеству карбонилов: монокетоны (1 карбонил), поликетоны (2 или более карбонилов).
Кетоны используются в качестве растворителей, в том числе для удаления лака с ногтей.
Согласно IUPAC, -one является его суффиксом, который указывает на органическую функцию кетонов.
Фенолы
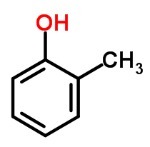
Ты фенолы они состоят из углерода и водорода, связанных с гидроксилами.
Они растворяются в спирте и эфире, и большинство из них едкие и токсичные. Они классифицируются по количеству присутствующих гидроксилов: монофенолы (1 гидроксил), дифенолы (2 гидроксила) и трифенолы (3 гидроксила).
Они используются при производстве взрывчатых веществ, бактерицидов, фунгицидов и креолина.
эфиры
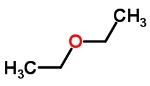
Ты эфиры очень легковоспламеняющиеся соединения, образованные кислород между двумя углеродными цепями. Они бывают в жидком, твердом и газообразном состоянии и имеют очень сильный запах.
Они могут быть симметричными (одинаковые радикалы) или асимметричными (разные радикалы).
В качестве растворителей используются эфиры.
Приставка указывает количество атомов углерода, как и остальные соединения. Однако сторона кислорода с наименьшим углеродным суффиксом - -oxy, а кислородная сторона с наибольшим суффиксом углерода - -year.
Карбоновые кислоты
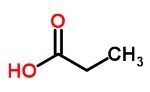
Слабые кислоты, образованные карбоксилом, часто имеют неприятный запах.
Он присутствует в уксусе (этаноловая кислота), в потоотделении, во фруктах (аскорбиновая кислота).
Ты карбоновые кислоты они могут быть алифатическими, когда его цепь открыта, или ароматическими, когда есть ароматическое кольцо.
Они классифицируются по количеству имеющихся в них карбоксилов: монокарбоновые (1 карбоксил), дикарбоновые (2 карбоксил) и трикарбоновые (3 карбоксил).
Согласно IUPAC, суффикс -oic указывает на органическую функцию карбоновых кислот.
Тоже читай Органические функции.
Упражнения для вступительных экзаменов с обратной связью
1. (Mackenzie-SP) Об этаноле, структурная формула которого H3C CH2 ─ Ой, определите неправильную альтернативу:
а) имеет насыщенную углеродную цепь.
б) представляет собой неорганическое основание.
в) растворим в воде.
г) является моноспиртом.
д) представляет собой однородную углеродную цепочку.
Альтернатива б
2. (UFRN) Соединение, которое используется в качестве апельсиновой эссенции, имеет формулу:
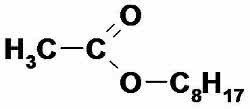
а) метилбутаноат.
б) этилбутаноат.
в) н-октилэтаноат.
г) н-пропилэтаноат.
д) этилгексаноат.
Альтернатива c
3. (UFU-MG) Правильное название соединения ниже, согласно IUPAC:
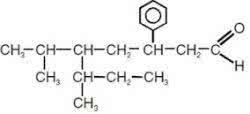
а) 3-фенил-5-изопропил-6-метилоктаналь
б) 3-фенил-5-втор-бутил-6-метилгептаналь
в) 3-фенил-5-изопропил-6-метилоктанол
г) 2-фенил-4-изопропил-5-метилоктаналь
д) 4-изопропил-2-фенил-5-метилгептаналь
Альтернативой
4. (У. Católica de Salvador - BA) Кетон представляет собой карбонильное соединение с 3 атомами углерода и насыщенной цепью. Его молекулярная формула:
а) В3ЧАС6О
до н.э3ЧАС7О
в) С3ЧАС8О
Округ Колумбия3ЧАС8О2
д) С3ЧАС8О3
Альтернативой
5. (PUC-PR) Что касается 3-фенилпропановой кислоты, правильно сказать, что:
а) имеет молекулярную формулу C9ЧАС10О2.
б) имеет четвертичный атом углерода.
C) имеет 3 ионизируемых атома водорода.
г) не является ароматическим соединением.
д) представляет собой насыщенное соединение.
Альтернативой

