Чтобы химическая реакция произошла, необходимо выполнение четырех основных условий, а именно:
1. Реагенты должны контактировать;
2. Между реагентами должно быть химическое сродство;
3. Столкновения между частицами реагента должны быть эффективными;
4. Энергия активации должна быть достигнута.
Кратко просмотрите каждый случай:
1.Контакт между реагентами:
Это условие очевидно, потому что даже если реагенты имеют большое сродство друг к другу, как в случае кислот и оснований, если они разделены, реакция не произойдет. Они должны вступить в контакт, чтобы их частицы могли столкнуться, разрывая связи реагентов и образуя связи продуктов.

2.Химическое сродство:
Как мы видели, соприкосновение реагентов необходимо, но недостаточно. Например, если мы введем натрий в контакт с водой, произойдет чрезвычайно бурная реакция, но если мы добавим золото, мы не увидим никакой разницы. Это связано с тем, что разные вещества имеют различное химическое сродство друг с другом или могут вообще не иметь сродства. Чем больше химическое сродство, тем быстрее реакция.
В упомянутых примерах натрий имеет такое большое сродство с водой, что, чтобы не вступать в контакт с влагой воздуха, металлический натрий хранится в керосине. Золото инертно, поэтому золотые памятники служат так долго, как египетские саркофаги.

3.Теория столкновений:
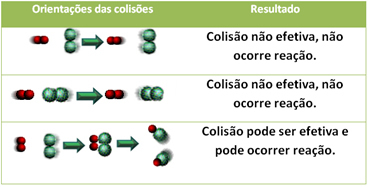
Даже в соединениях, обладающих химическим сродством, для протекания реакции необходимо, чтобы их частицы, атомы или молекулы эффективно сталкивались. Не все сталкивающиеся частицы делают это эффективно, но удары, которые приводят к разрушению реагентные связи и образование новых - это те связи, которые происходят в правильной ориентации и с энергетической достаточно.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Ниже показан случай двух неэффективных столкновений и одного эффективного столкновения, в результате которого происходит реакция.
4.Энергия активации и активированный комплекс:
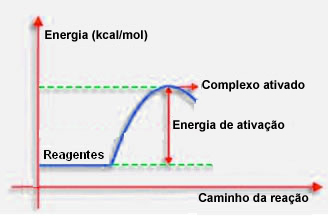
Как указывалось в предыдущем пункте, эффективное столкновение, помимо благоприятного наведения, также требует достаточной энергии. Минимальное количество энергии, необходимое для каждой реакции, называется энергией активации.
Если реагенты имеют энергию, равную или превышающую энергию активации, во время хорошо ориентированного удара образуется первоначально активированный комплекс, который является промежуточной структурой между реагентами и продукты. В активированном комплексе происходит ослабление связи реагентов и образование новых продуктовых связей.
Таким образом, энергия активации работает как своего рода барьер для протекания реакции, потому что чем она больше, тем труднее будет протекать реакции. В некоторых случаях необходимо подводить энергию к реагентам. Например, газ для приготовления пищи имеет свойство взаимодействовать с кислородом в воздухе, но нам нужно подавать энергию, когда мы собираем спичку, иначе реакция не состоится. Но как только реакция началась, сама реакция высвобождает достаточно энергии, чтобы активировать другие молекулы и поддерживать реакцию.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Условия возникновения химических реакций»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Доступ 27 июня 2021 г.


