Ковалентная связь это тип взаимодействия между атомами, имеющими высокую электроотрицательность, то есть высокая склонность к получению электронов. Химические элементы, обычно участвующие в этом типе связи:
Водород (H)
Бериллий (Be)
Бор (B)
Углерод (C)
Азот (N)
Фосфор (P)
Кислород (O)
Сера (S)
Фтор (F)
Хлор (Cl)
Бром (Br)
Йод (I)
а) Природа задействованных элементов
К химическим элементам, которые обладают высокой электроотрицательностью и, следовательно, имеют ковалентные связи, относятся:
Водород
Аметалс
б) Возникновение ковалентной связи
В зависимости от природы химических элементов, участвующих в ковалентной связи, это может происходить следующим образом:
Между двумя атомами водорода;
Между атомом неметалла и водородом;
Между атомами одного химического элемента (неметалла);
Между атомами разных химических элементов (обоих неметаллов).
в) Количество электронов, которые должен получить каждый атом.
Число электронов, которые каждый неметалл или атом водорода получает в связи, связано с Правило октета.
Согласно правилу октетов, атом является стабильным, когда он приобретает восемь или два электрона (только в случае водорода) в валентной оболочке. Например, если атом имеет пять электронов в валентной оболочке, он должен получить три электрона для достижения стабильности.
ПРИМЕЧАНИЕ. Бериллий и бор являются исключения из правила октетов, по мере того, как они становятся стабильными с 4 и 6 электронами в валентной оболочке соответственно.
Число электронов в валентной оболочке можно легко определить, анализируя семейство химических элементов. В таблице ниже у нас есть количество электронов в валентной оболочке, относящееся к семейству, к которому принадлежит элемент, и количество электронов, которое он должен получить для достижения стабильности:

г) Принцип ковалентной связи
Как и в случае ковалентной связи, все задействованные атомы имеют тенденцию получать электроны, обязательно, между ними будет разделение электронов, присутствующих в валентной оболочке (уровень, наиболее удаленный от ядра).
Разделение происходит, когда электрон из валентной оболочки атома становится частью того же электронного облака, которое окружает другой электрон из валентной оболочки другого атома.
Например, у каждого атома водорода есть электрон в валентной оболочке. Когда два электрона становятся частью одного облака, каждый Водород начинает иметь два валентных электрона, то есть стабилизируется.
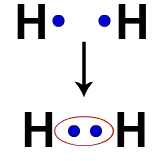
Электроны двух атомов водорода, находящихся в одном электронном облаке
д) Формулы, используемые для ковалентного связывания
1ª) молекулярная формула
Это показатель количества атомов каждого элемента, образующего молекулу, образованных ковалентными связями.
Пример: H2О
В молекуле воды 2 атома водорода и 1 атом кислорода.
2ª) структурная формула
Структурная формула демонстрирует организацию молекулы, то есть демонстрирует связи между атомами. Для этого используются тире, обозначающие связь каждого атома:
Простой (?): Указывает, что атом разделяет только один электрон из своей валентной оболочки с другим атомом и наоборот;
Двойной (?): Указывает, что атом разделяет два электрона из своей валентной оболочки с другим атомом и наоборот;
Тройной (≡): указывает, что атом разделил три электрона из своей валентной оболочки с другим атомом и наоборот.
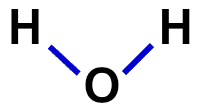
Структурная формула воды
3ª) Электронная формула Льюиса
Электронная формула Льюиса также представляет организацию молекулы (электронная формула), но она направлена на демонстрацию разделения электронов в атомах.
Чтобы построить его, достаточно уважать организацию, предложенную в структурной формуле, и заменять каждый след связей (одинарных, двойных или тройных) на «два шара», которые представляют собой электроны.
Например, в структурной формуле воды есть две простые связи между водородом и кислородом. Таким образом, между ними у нас будет только два шара, разделенных эллипсом (который представляет собой электронное облако).
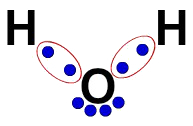
Электронная формула воды Льюиса
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm


