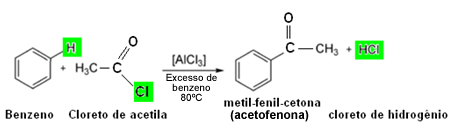
Хлориды - это те ионные соединения, которые содержат анион Cℓ-1.
Хлор относится к семейству 17 или 7A, его атомный номер равен 17, и он имеет 7 электронов в валентной оболочке (самой внешней электронной оболочке атома). В соответствии с правило октета, чтобы быть стабильным, он должен иметь 8 электронов в этой последней оболочке и, следовательно, должен получить еще один электрон. Когда это происходит, то есть когда он получает электрон, как правило, из ионной связи с металлом, образуется â.хлорид ниона (Cℓ-1), металл, отдавший электрон, становится катионом, а образовавшееся вещество - ионным.
Хлориды - это соли, полученные в результате реакции основания с соляной кислотой (HCℓ(здесь)). Основание обеспечивает катион, а соляная кислота обеспечивает хлорид-ион:
Базовое основание + соляная кислота → Хлорид + вода
ÇОН + НCℓ → ÇCℓ + H2О
Все хлориды классифицируются как неорганические соли, поскольку в водной среде они выделяют катион, отличный от H+ и высвободить хлорид-анион, а не гидроксил (OH-).
Номенклатура хлоридов всегда следует этому правилу: Хлорид +de + (название элемента, связанного с хлором). В ваши формулы сформированы обмен ионных зарядов на индексы (число в правом нижнем углу символа элемента, указывающее количество атомов этого элемента, образующих связи).

если индекс равен «1», вам не нужно записывать его в формуле, как показано ниже:
В+1 Cℓ-1 → В1Cℓ1 → ВCℓ: хлорид натрия;
K+1 Cℓ-1 → KCℓ: хлорид калия;
Здесь+2 Cℓ-1→CaCℓ2: хлорид кальция;
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Ба+2 Cℓ-1→ Bздесь2: хлорид бария;
Aℓ+3 Cℓ-1→ACℓ3: хлорид алюминия.
Однако, как объясняется в тексте «Ионные вещества группы: хлорид, карбонат, нитрат и сульфат”, Как и все ионные вещества, хлориды не имеют изолированных в природе унитарных формул, поскольку их ионы взаимно притягиваются друг к другу и образуют кристаллические решетки.
Основным примером хлорида, который присутствует в нашей повседневной жизни, является хлорид натрия, NaC, поваренная соль. Посмотрите на ионную связь, которая приводит к ее образованию (в которой натрий отдает электрон хлору) и ниже кристаллической решетки этой соли:

В кристаллической решетке хлорида натрия каждый анион Cℓ- окружен 6 катионами Na+ и наоборот, поэтому координационное число этой кристаллической решетки равно 6.
Все хлориды твердые вещества в окружающих условиях и довольно вода, являясь одной из самых распространенных солей, встречающихся в нашей повседневной жизни, учитывая, что некоторые из них присутствуют растворенными в минеральной воде, питьевой воде, водопроводной воде, реках, морях, среди другие. Исключением являются нерастворимые в воде хлориды хлорид серебра (AgCℓ - показан на следующем рисунке) из соединения свинца, меди и ртути.

Нерастворимый в воде хлорид серебра *
Ионы Cℓ-1 из хлоридов, которые мы глотаем, в основном в соль, рыба и мясо, важны для некоторых функций человеческого организма, так как являются основными внеклеточными анионами, присутствующими в соке. желудочный, регулируют биологические жидкости, такие как распределение воды в организме, и поддерживают осмотическое давление и нейтральность плазмы электрический.
Его недостаток может вызвать беспокойство, диарею и проблемы с кровообращением. Его избыток выводится с мочой (в среднем каждый человек выделяет около 4 г хлорида в сутки), потом и калом.
*Кредит изображения: Автор: Дэнни С. / Изображение извлечено из: Wikimedia Commons
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы ссылаться на этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Хлориды»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/cloretos.htm. Доступ 28 июня 2021 г.
Химия

Повседневные соли, карбонат кальция, хлорид натрия, фторид натрия, нитрат калия, нитрат натрия натрий, карбонат натрия, бикарбонат натрия, бикарбонат натрия, сульфит натрия, селитра, сода.