Французский химик Жозеф Луи Пруст (1754-1826) провел тщательные эксперименты, связанные с массами компонентов определенных реакций.
Например, элементы, из которых состоит вода, - это водород и кислород. Пруст обнаружил, что в этой реакции образования воды водород всегда взаимодействует с кислородом в постоянном и определенном соотношении, которое составляет 1: 8 соответственно. Посмотрите, как это происходит ниже:

Заметь независимо от того, какая масса использованных элементов, пропорции всегда будут одинаковыми.
Пруст отмечал, что дело обстоит не только с водой, но и со всеми другими веществами.
15,06 г сульфида меди (CuS) получают, например, при взаимодействии 10,00 г металлической меди (Cu) с 5,06 г серы (S). Итак, если мы удвоим количество меди (которое увеличится до 20,0 г), и если мы хотим, чтобы вся медь прореагировала, также потребуется удвоить количество серы, до 10,12 г, с общим образованием 30,12 г сульфид.
Теперь, если добавлено непропорциональное количество, избыточное количество останется, оно не отреагирует. Обратите внимание на это ниже:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
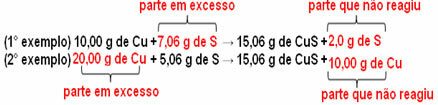
Заметь реакция протекает только в определенной пропорции. Поэтому в 1799 году Пруст пришел к выводу, что когда несколько веществ объединяются в соединение, это всегда происходит в определенном соотношении масс.
Поэтому он создал Закон, который называется Закон Пруста, Закон постоянных пропорций или же Закон определенных пропорций, который гласит:

Этот закон и Закон Лавуазье (Закон сохранения массы) названы Законы о весе, потому что они говорят массой задействованных веществ.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Закон Пруста или Закон постоянных пропорций»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Доступ 27 июня 2021 г.