Металлы представляют собой элементы, характеризующиеся яркостью, прочностью, теплопроводностью и электропроводностью. Они есть применим практически во всех промышленных процессах, присутствуют в металлических сплавах, используемых в производстве инструментов, ювелирных изделий и монет, а также в химических процессах, таких как окислительно-восстановительный потенциал, ответственных за работу стеки и аккумуляторы.
В Периодической таблице они подразделяются на:
полуметаллы
переходные металлы
щелочных металлов
щелочноземельные металлы
В сталелитейной промышленности они делятся на:
черные металлы
Цветные металлы
тяжелые металлы
Читайте тоже: Какие новые элементы периодической таблицы?
Характеристики металла

По большей части они отлично проводят тепло и электроэнергию.
У них глянцевый вид.
иметь высокий плотность.
Это электроположительные элементы (они имеют тенденцию образовывать катионы - положительные заряды).
За исключением Меркурий, это элементы с высокой температурой плавления, твердые при комнатной температуре.
Обладают механической прочностью (цепкостью).
Они податливы (можно формовать, не ломаясь).
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Металлы периодической таблицы
щелочных металлов
Элементы первый столбец периодической таблицы, семейство 1А. Их называют щелочными металлами, потому что при смешивании с водой они образуют гидроксиды, то есть щелочной (основной) раствор.
Ты элементы К этой группе принадлежат:
Литий (ли)
Натрий (В)
Калий (К)
Рубидий (Rb)
Цезий (Cs)
Францио (Пт)
Электронная конфигурация щелочных металлов в нейтральном состоянии (незаряженный / ионизированный) представлена только электрон в последней оболочке (валентный слой). О атомный луч и реакционная способность этих металлов увеличивается сверху вниз (соблюдая Периодическая таблица). Они имеют низкую температуру плавления по сравнению с другими металлами, податливы и не очень плотны, имеют матовый вид из-за высокий окислительный потенциал.
Смотрите также:Каковы свойства материи?
щелочноземельные металлы
Это элементы, которые появляются в второй столбец таблицы Менделеева, семейство 2А. называются щелочноземельный склонностью к образованию растворов основного (щелочного) характера и землистых, потому что до 19 века так обозначали оксиды, образованные этими веществами. Этот термин использовался для обозначения нерастворимых металлов, которые не подвергались мутации при нагревании, общих характеристик элементов группы 2. Позже, в свете новых исследований и экспериментов, было обнаружено, что «земные» элементы на самом деле были оксидами, образованными металлами.
Это ковкие металлы с низкой плотностью, два электрона в его внешней оболочке, находятся при нормальных условиях температуры и давления в твердом состоянии. К этой группе относятся:
Бериллий (Быть)
Магний (Мг)
Кальций (Здесь)
Стронций (г)
Барий (Ба)
Радио (Лягушка)
переходные металлы
составить группа B Периодической таблицы, и расположены между щелочноземельными металлами и металлы. Они были определены IUPAC как элементы, которые имеют неполный энергетический подслой energéticad. Термин "переходные металлы" относится к переход из 2 группы в 13 в Периодической таблице и увеличивающееся добавление электронов на "d" -орбитали.
Группа переходных металлов состоит из плотных элементов с высокими температурами плавления и кипения, и менее реакционноспособен, чем металлы 1 и 2 групп (Семейство 1А и 2А). К переходным металлам относятся вольфрам, который является элементом с самой высокой температурой плавления (3422 ° C), и ртуть (Hg), которая представляет собой металл, находящийся в жидком состоянии при нормальных условиях температуры и давления, его температура плавления (-38,83 ° C).
Переходные металлы имеют различные степени окисления (NOX переменная) и образуют окрашенные вещества.

Внутренние переходные элементы
Внутренние переходные элементы они есть:
Лантаноиды: серия, состоящая из элементов, которые имеют от 57 до 71 протона и которые, за исключением прометия, являются естественными.
Актиниды: группа, образованная элементами с атомным номером от 89 до 103, которые по большей части являются синтетическими. Вся эта группа радиоактивный с коротким периодом полураспада.
Элементы этих двух групп имеют высокую температуру плавления и все твердые при комнатной температуре.
Полуметаллы
Ты полуметаллы Всего существует семь элементов:
Бор (B)
Кремний (Si)
Германий (Ge)
Мышьяк (As)
Сурьма (Пн)
Теллур (Te)
Полоний (Po)
Эта классификация дается элементам, имеющим физико-химические характеристики, относящиеся к металлам, а также другие, относящиеся к неметаллическим элементам. Полуметаллы имеют блеск, представляют собой хрупкие соединения, способные образовывать катионы, а также анионы (в зависимости от состояния) и являются промежуточными проводниками.
Типы металлов
Железо: вещества, содержащие в своем составе железо. Они есть металлические сплавы которые содержат железо в качестве обычного элемента, но могут быть приготовлены с различными концентрациями углерод, например, или выкованные с использованием разных технологий, в результате чего получаются изделия с разными физическими свойствами.
Цветной: сплавы, образованные другими типами металлов, такими как алюминий, медь, никель, цинк, титан.
Тяжелые металлы: свинец, никель, цинк, ртуть. Это химически активные, токсичные металлы, способные к биоаккумуляции. Они используются, среди прочего, в батареях, лампах, боеприпасах для военных артефактов.
Химические связи металлов
Металлы элементы электроположительный, то есть они имеют тенденцию терять электроны в химической связи. Когда металл взаимодействует с неметаллом, он выполнить ионную связь из-за разницы в электроотрицательность. Другая возможность связывания металлов - это металлические связи.
В металлические соединения происходят между металлами с частичным высвобождением электронов и образованием облака или моря электронов вокруг атомов, что гарантирует металлическим частям свойства проводимость электрическая и пластичность.
Смотрите также: Проводники и изоляторы - в чем отличия?
Получение металлов
Большинство металлов естественным образом содержится в горные породы и минералы, связанные с другими элементами. Есть несколько методов рафинирования металлов, таких как электролиз и химические реакции для разделения соединений.
В случае металлов двумя наиболее часто используемыми в промышленном масштабе методами для получения металла определенной степени чистоты являются: разница плотность и магнитная восприимчивость (тенденция к тому, что металл должен реагировать на магнитное поле).

решенные упражнения
Вопрос 1 - (Enem) Кадмий, присутствующий в батареях, может достигнуть земли, когда эти материалы нерегулярно выбрасываются в окружающую среду или когда они сжигаются. В отличие от металлической формы ионы Cd2 + чрезвычайно опасны для организма, так как могут заменять Ионы Ca2 +, вызывающие дегенеративное заболевание костей, делают их очень пористыми и вызывают сильную боль в костях. суставы. Они также могут ингибировать ферменты, активируемые катионом Zn2 +, которые чрезвычайно важны для работы почек. На рисунке показано изменение радиуса некоторых металлов и соответствующих им катионов.
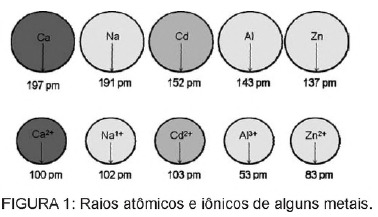
Судя по тексту, токсичность кадмия в его ионной форме является следствием действия этого элемента.
A) обладают низкой энергией ионизации, что способствует образованию иона и облегчает его связывание с другими соединениями.
Б) имеют тенденцию действовать в биологических процессах, опосредованных катионами металлов с зарядами от +1 до +3.
C) имеют радиус и заряд, относительно близкие к ионам металлов, которые действуют на биологические процессы, вызывая вмешательство в эти процессы.
D) имеют большой ионный радиус, что позволяет ему вмешиваться в биологические процессы, в которых обычно участвуют ионы меньшего размера.
E) имеют заряд +2, что позволяет ему вмешиваться в биологические процессы, в которых обычно участвуют ионы с более низким зарядом.
разрешение
Альтернатива C. Кадмий - это элемент, похожий на ионы металлов, которые естественным образом содержатся в организме. Помимо способности к биоаккумуляции, кадмий, имея сходство с металлическими группами, может связываться с сульфгидрильными группами молекул. белка, вызывая изменения в биологических процессах, таких как декальцификация, разрушение тканей и эритроцитов. кровь.
Вопрос 2 - Для характеристик, относящихся к металлам, отметьте неправильный вариант.
А) Большинство металлов являются хорошими проводниками электричества и тепла.
Б) Некоторые металлы подвержены окислению и / или восстановлению.
В) Железо - прочный и ковкий металл, то есть его легко формовать.
D) Щелочноземельные металлы имеют это название «земля», относящееся к оксидам этих металлов, которые имеют темный цвет.
E) Металлы - это элементы разного цвета и тусклые из-за действия окисления.
разрешение
Альтернатива E. Металлы имеют естественный блеск и металлический цвет, они могут подвергаться окислению, что приводит к изменению характеристик, относящихся к аспект детали, но это не явление, которое происходит со всеми металлами, и в некоторых случаях окисление зависит от нескольких факторов. внешний.
Лайса Бернардес
Учитель химии