
Количество калорий зависит от состава пищи. Итак, чтобы экспериментально определить количество тепла, выделяемого пищей и поглощаемого телом, мы используем устройство под названием калориметр.
Это устройство измеряет тепло, выделяемое пищей при ее сжигании. Есть несколько типов калориметров; первая из них была создана в 1780 году Лавуазье и Лапласом и была ледяной калориметр.
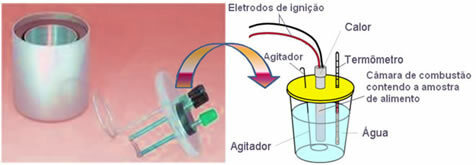
В настоящее время наиболее часто используемым и учитывающим концепцию калорий, описанную выше, является водяной калориметр. Это устройство покрыто изоляционным материалом для предотвращения потери тепла из среды; и пища для анализа помещается в камера сгорания, который содержит газообразный кислород и электроды. Эти электроды подвергаются электрическому разряду и вызывают возгорание и возгорание пищи.
Известная масса воды, содержащейся в калориметре, поглощает тепло, выделяемое сгоревшей пищей, и термометр измеряет повышение температуры воды. Кроме того, калориметр содержит агитатор что позволяет температуре воды оставаться неизменной во всем ее объеме.
Итак, если мы используем, например, массу в 1 грамм сахара, а в калориметре 1000 г воды, и мы наблюдаем, что в итоге реакции температура воды упала с 20 ° C до 24 ° C, то есть она увеличилась на 4 ° C, тогда мы можем достичь энергетической ценности сахар. Нравиться? Что ж, учитывая исходную концепцию калорийности, мы имеем:
| Повышение с 1 ° C → 1 кал на грамм воды |
| Повышение с 4 ° C → 4 кал на грамм воды |
Так 1 г воды поглощает 4 извести. Однако было использовано 1000 г воды, и, учитывая, что все тепло, выделяющееся при сгорании, было поглощено ею, общая энергия, поглощенная водой, составила 4000 кал или 4 ккал. Таким образом, мы заключаем, что:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
| Энергетическая ценность сахара = 4000 кал / г или 4 ккал / г. |
Переход на СИ:
1 ккал 4,18 кДж
4 ккал / г x
x = 16,72 кДж / г
Кроме того, мы можем использовать следующее уравнение для расчета количества тепла, отдаваемого или поглощаемого водой:
| Q = м. ç. т |
Где:
Q = тепло, отдаваемое или поглощаемое водой;
m = масса воды;
c = удельная теплоемкость воды, равная 1,0 кал / г. ° C или 4,18 Дж / г. ° C;
Δt = изменение температуры воды, которое определяется уменьшением конечной температуры на начальную (tж - тя).
Используя эту формулу, мы получаем тот же результат:
Q = м. ç. т
Q = 1000 г. 1,0 кал / г. ° C. (24-20) ° С
Q = 4000 кал.
Q = 4,0 ккал
или же
Q = м. ç. т
Q = 1000 г. 4,18 кДж / г. ° C. (24-20) ° С
Q = 16,72 кДж
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы ссылаться на этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Измерение пищевых калорий с помощью калориметра»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm. Доступ 27 июня 2021 г.


