В этом материале вы будете следовать пошаговым решениям и обоснованиям ответов различных упражнения на химический баланс, которые охватывают несколько тем в этой важной области физической химии.
1- Константа равновесия по концентрации в моль / л
Пример: (PUC-RS) Равновесие, связанное с образованием кислотных дождей, представлено уравнением:
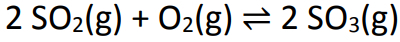
В литровом контейнере смешали 6 моль диоксида серы и 5 моль кислорода. Через некоторое время система достигла равновесия, и измеренное число молей триоксида серы составило 4. Приблизительное значение константы равновесия:
а) 0,53
б) 0,66
в) 0,75
г) 1,33
д) 2,33
Правильный ответ: Буква d
В упражнении предлагается рассчитать константу равновесия в единицах концентрации моль / л. Чтобы провести этот расчет, мы должны использовать значения равновесия для каждого участника реакции. Выражение Kc представляет собой результат умножения концентраций продуктов, деленных на произведение концентраций реагентов:
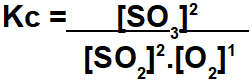
Мы должны быть очень осторожны при определении значений каждого участника в балансе, так как упражнение не всегда предоставляет эти данные, как в случае с этим примером. Итак, мы должны выполнить следующие шаги:
Шаг 1: Составьте таблицу с известными значениями.
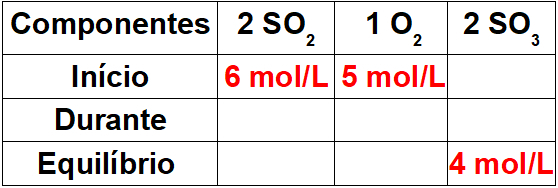
Поскольку это начало реакции, продукт будет иметь нулевую концентрацию. Поскольку равновесное значение в продукте всегда равно сумме начала и во время реакции, значение во время реакции будет 4 моль / л.

Шаг 2: Определите значения во время реакции.
Чтобы определить значения реагентов во время реакции, достаточно связать известное значение для продукта со значениями реагентов, используя стехиометрическое соотношение. У нас 4 моль / л SO3 во время реакции для пропорции 2 на балансе. Как доля ОС2 тоже 2, у нас будет 4 моль / л в процессе. к O2, у нас будет только 2 моль / л, потому что его стехиометрический коэффициент равен 1.

Чтобы завершить таблицу, достаточно вычесть начальное значение на значение периода, чтобы мы могли определить равновесные значения для реагентов.

Шаг 3: Определите значение Kc.
Чтобы определить значение Kc, просто используйте значения, найденные в равновесии в приведенном ниже выражении:

2- Константа равновесия по парциальному давлению
Пример: (SANTOS-SP) Обратите внимание на уравнение равновесия ниже:
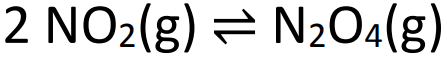
При достижении вышеуказанного баланса давление составляет 2 атм и 50% NO.2 в объеме. Значение константы равновесия в парциальных давлениях (Kp) должно быть:
а) 0,2
б) 0,25
в) 1
г) 0,5
д) 0,75
Правильный ответ: Буква c
Это упражнение показывает, что полное давление в системе в состоянии равновесия составляет 2 атм и что имеется 50% (мольная доля) NO.2. Итак, сначала мы должны определить парциальное давление для каждого газа в состоянии равновесия, умножив общее давление на молярную долю:
к НЕТ2:
pNO2 = 0,5. 2
pNO2 = 1 атм
К N2О4: поскольку в системе всего два газа, процентное содержание N2О4 также будет 50%, чтобы в итоге получить 100%.
pN2О4 = 0,5. 2
pN2О4 = 1 атм
Константа равновесия, выраженная в парциальных давлениях, вычисляется путем деления результата на умножение парциальных давлений газообразных продуктов на произведение давлений реагентов газообразный. В этом случае выражение Kp будет:

3- Смещение баланса
Пример: (PUCCAMP) Образование сталактитов, отложений карбоната кальция, существующих в пещерах недалеко от богатых известняком регионов, может быть представлено следующей обратимой реакцией:

Пожалуйста, соблюдайте следующие условия:
Я. Постоянное испарение воды
II. Поток холодного и влажного воздуха
III. Повышение температуры внутри пещеры
IV. Снижение температуры внутри пещеры
Какие из этих условий способствуют образованию сталактитов?
а) I и II
б) I и III
в) II и III
г) II и IV
д) III и IV
Правильный ответ: Письмо B
Сталактиты - это структуры, образованные карбонатом кальция (CaCO3). Утверждение ставит под вопрос, какие из указанных условий способствуют образованию сталактитов. Следовательно, это упражнение о смещение равновесия, поскольку образование CaCO3 происходит, когда баланс смещается в вашу сторону (влево).
I- Верно, потому что, когда она испаряется, количество воды (присутствующей слева от баланса) уменьшается. В соответствии с принцип Ле Шателье, когда концентрация участников снижается, баланс всегда смещается в их сторону.
II- Неверно, поскольку пещеры - это холодные и влажные места, поэтому прямая реакция образования сталактитов экзотермична. Если поток холодного влажного воздуха способствует экзотермическому процессу и увеличивает количество воды, войти в пещеру, реакция будет смещена в прямом направлении, не способствующем образованию сталактиты.
III- Верно, поскольку пещеры - это холодные и влажные места, и прямая реакция экзотермическая, если температура увеличение пещеры, реакция будет смещена в непрямом направлении (эндотермическом), что будет способствовать образованию сталактиты.
IV- Неверно, поскольку пещеры - это холодные и влажные места, и прямая реакция экзотермична, если температура пещера уменьшается, реакция будет смещена в прямом направлении (экзотермическая), что не будет способствовать образованию сталактиты.
Смотрите также:Химический баланс в пещерах
4- Константа ионизации
Пример: (UECE) Концентрация [H+] решения 6 × 10-7 моль / литр кислоты H2S, с константой ионизации Ki 10-7, это то же самое, что:
а) 5 × 10-7 моль / литр
б) 6 × 10-7 моль / литр
в) 3 × 10-6 моль / литр
г) 2 × 10-7 моль / литр
Правильный ответ: Буква d
Поскольку у нас есть только одна кислота или одно основание, это упражнение в константа ионизации (Ки). Итак, чтобы решить этот вопрос, мы должны знать концентрации ионов и электролита (кислоты или основания).
Чтобы начать решение упражнения по константе ионизации, мы должны использовать уравнение кислотной ионизации (в случае упражнения H2S) или основание.
Не останавливайся сейчас... После рекламы есть еще кое-что;)

Согласно составленному уравнению, концентрация H+ совпадает с HS- в равновесии из-за стехиометрической пропорции. Поскольку мы не знаем этих ценностей, мы будем использовать x для обеих концентраций.
Примечание: мы можем использовать x для обеих концентраций, потому что мы имеем дело с продуктом.
Шаг 1: Сборка выражения Ki.
Сборка выражения константы ионизационного равновесия следует тому же принципу константы в терминах концентрации в моль / л.
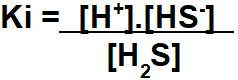
Шаг 2: Используйте значения, указанные в упражнении, в собранном выражении Ki.

Шаг 3: Рассчитайте значение дельты.

Шаг 4: Вычислить возможное значение x для найденной дельты.

Для x1
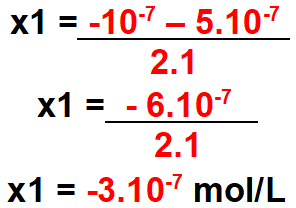
Примечание: концентрация не может быть отрицательной. Значит, это значение недействительно.
Для x2

5- Закон разбавления Оствальда
Пример: (ITA) В водном растворе монокарбоновой кислоты 0,100 моль / л при 25 ° C кислота диссоциирует на 3,7% после достижения равновесия. Отметьте вариант, который содержит правильное значение константы диссоциации этой кислоты при этой температуре.
а) 1,4
б) 1,4 × 10-3
в) 1,4 × 10-4
г) 3,7 × 10-2
д) 3,7 × 10-4
Правильный ответ: Буква c
Через Закон разбавления Оствальда, рассчитываем константу ионизации (Ki) сильного электролита (α больше 5%) по формуле:

Для расчета константы ионизации слабого электролита (α меньше 5%) воспользуемся следующей формулой:
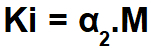
Упражнение по закону разбавления Оствальда легко узнать, поскольку оно представляет концентрацию в моль / л (в данном случае 0,100 моль / л). одного электролита (монокарбоновая кислота), процент диссоциации (α = 3,7%) или константа диссоциации или ионизации (Ки).
Поскольку кислота слабая, значит:

6- Химический баланс с участием pH и pOH
Пример: (PUC-MG) В трех контейнерах X, Y и Z содержатся неизвестные основные растворы с концентрацией 0,1 моль / л. Измеряя pH трех растворов с помощью универсальной индикаторной бумаги, были получены следующие значения, соответственно: pH = 8, pH = 10 и pH = 13. Отметьте ПРАВИЛЬНОЕ утверждение:
а) Концентрация ОН- базы Z равно 10-13 Молл.
б) Кбайт по основанию X больше, чем Кбайт по основанию Y.
c) База Y проводит электрический ток лучше, чем база Z.
г) Основание X полностью ионизировано.
д) В бутылке Z содержится прочное дно.
Правильный ответ: Буква е
Чтобы приступить к решению этого упражнения, необходимо запомнить несколько важных моментов:
Первый: pH + pOH = 14
Второй: чем выше pH по отношению к значению 7, тем более щелочным будет раствор. Чем щелочнее раствор, тем больше концентрация гидроксид-анионов [OH-].
В третьих: [ОЙ-] = 10-pOH
Номер: чем меньше pOH, тем больше Kb, то есть тем более ионизированным или диссоциированным будет основание.
Итак, основываясь на этих знаниях, просто следуйте пошаговым инструкциям ниже, чтобы решить проблему:
Шаг 1: Определите pOH каждого раствора.
Для решения X:
pH + pOH = 14
8 + pOH = 14
рОН = 14-8
pOH = 6
Для раствора Y:
pH + pOH = 14
10+ pOH = 14
рОН = 14-10
рОН = 4
Для раствора Z:
pH + pOH = 14
13 + pOH = 14
рОН = 14-13
pOH = 1
Шаг 2: Чтобы судить об альтернативе A, мы должны определить концентрацию гидроксида в растворе Z.
[ой-] = 10-pOH
[ой-] = 10-1 Молл,
Вскоре альтернатива A неверна.
Шаг 3: Сравните базу X Kb с базой Y.
База X Kb меньше, чем база Y Kb, потому что ее pOH больше. Вскоре альтернатива B неверна.
Шаг 4: Свяжите pOH с силой и диссоциацией.
Электропроводимость лучше всего происходит в растворах с сильным электролитом с более высоким pOH. База Y не проводит электрический ток лучше, чем база Z, потому что его pOH ниже, поэтому выделяется меньше ионов. Итак альтернатива C неверна.
Шаг 5: Связать pOH с диссоциацией.
Чем меньше pOH, тем сильнее диссоциировало основание. Поскольку раствор с самым высоким pOH находится в контейнере X, он содержит наименее диссоциированный раствор. Следовательно альтернатива D ложна.
Смотрите также: PH рта и кариес
7- Буферный раствор
Пример: (UFES) pH крови человека поддерживается в узком диапазоне (7,35–7,45) с помощью различных буферных систем. Укажите единственную альтернативу, которая может представлять одну из этих буферных систем:
а) CH3COOH / NaCl
б) HCl / NaCl
в) H3ПЫЛЬ4 / NaNO3
г) КОН / KCl
д) H2CO3 / NaHCO3
Ответ на этот вопрос - альтернатива E, потому что это упражнение в буферный раствор или буферная система. Этот раствор относится к химическому балансу, образованному смесью двух растворов: кислоты (в упражнении H2CO3) или слабое основание и соль с таким же кислотным компонентом (при упражнениях NaHCO3) или базу.
а- Неверно, потому что это смесь, образованная слабой кислотой и солью, не имеющей кислотного компонента.
b - Неверно, потому что это смесь, образованная сильной кислотой, поскольку HCl является одной из трех сильных кислот (другие - HBr и HI).
c- Неверно, потому что это смесь, образованная умеренной кислотой и солью, не имеющей кислотного компонента.
г - Неверно, потому что это смесь, образованная сильным основанием (в нем есть элемент семейства щелочных металлов).
Смотрите также: Буферный раствор в крови человека
Автор: Диого Лопес Диас


