Текст "Молекула с асимметричным углеродом и оптическими изомерами»Показали, что когда в молекуле есть только один асимметричный или хиральный углерод (со всеми лигандами отличаются друг от друга), он имеет два оптически активных изомера и один оптически неактивный изомер (смесь рацемический).
Теперь давайте рассмотрим случай, когда существует два или более различных асимметричных атома углерода, то есть они считаются разными, потому что по крайней мере один из их лигандов не одинаковый. Например, рассмотрим формулу аспартама, который в 180 раз слаще сахарозы (сахара) и поэтому используется в искусственных подсластителях:
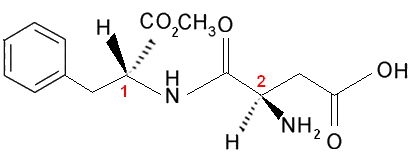
Обратите внимание, что эта молекула имеет два хиральных атома углерода, которые обозначены на изображении числами 1 а также 2. Эти атомы углерода имеют четыре группы связывания, отличающиеся друг от друга, поэтому они считаются асимметричными. При сравнении углеродных лигандов 1 с углеродными 2, мы видим, что единственным повторяющимся лигандом является H (водород), следовательно, это разные асимметричные атомы углерода.
Эта молекула и все те, у которых есть два асимметричных атома углерода, всегда будут иметь: 4 оптически активных изомера и 2 оптически неактивных изомера (две рацемические смеси).
Мы знаем это, потому что возможные вероятности:

Любые другие пары изомеров будут диастереоизомерами (которые не являются зеркальным отображением друг друга), например смесью правого углерода-1 и правого углерода-2.
Однако было бы очень сложно, если бы нам пришлось постоянно рассматривать все возможности для каждой молекулы, поскольку многие из них имеют 3, 4, 5 или более асимметричных атомов углерода.
Таким образом, наиболее простой способ определить количество оптически активных и неактивных изомеров молекулы, имеющей несколько различных асимметричных атомов углерода определяется математическими выражениями, показанными ниже, которые были предложены Ван'т Хоффом и Ле Бел:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
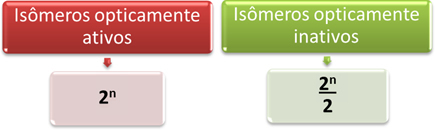
Где «n» - количество различных асимметричных атомов углерода в молекуле. Например, в случае аспартама это два асимметричных атома углерода, поэтому мы имеем:
- Оптически активные изомеры: 2нет = 22 = 4;
- Оптически неактивные изомеры: 2нет = 22 = 2.
2 2
Это дало именно ту сумму, о которой мы говорили ранее.
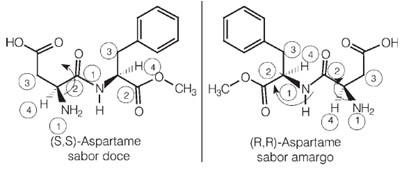
Интересно, что один из энантиомеров аспартама имеет сладкий вкус, который используется в искусственных подсластителях, но один из его оптических изомеров имеет горький вкус.
Теперь посмотрим на другой пример, молекулу фруктозы:
ОН ОН ОН ОН ОН
│ ║ │ │ │ │
H C ─ C ─ Ç ─ Ç ─ Ç ─ C ─ H
│ │ │ │ │
В О Н Ч Ч
Фруктоза имеет три асимметричных атома углерода, поэтому у нас есть 8 оптически активных изомеров и 4 оптически неактивных изомера, которые представляют собой 4 рацемические смеси.
- Оптически активные изомеры: 2нет = 23 = 8;
- Оптически неактивные изомеры: 2нет = 23 = 4.
2 2
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Изомеры в молекулах с разными асимметричными атомами углерода»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/isomeros-moleculas-com-carbonos-assimetricos-diferentes.htm. Доступ 28 июня 2021 г.