Как объяснено в тексте Насыщенность решений, химические растворы образуются при растворении растворенный на растворитель. У каждого растворенного вещества есть коэффициент растворимости специфический, который представляет собой максимальное количество растворенного вещества, растворимого в данном количестве растворителя при данном температура.
Построение графика с кривой растворимости
Например, коэффициент растворимости НКО3 составляет 31,2 г на 100 г воды при 20 ° C. Если растворить именно такое количество нитрата калия в 100 г воды при 20 ° C, получится насыщенный раствор. Любое дополнительное количество этой соли выпадет в осадок (образует нижнюю часть контейнера).

Однако коэффициент растворимости зависит от температуры. Итак, если нагреть этот насыщенный раствор с нижним телом KNO3, осадок будет постепенно растворяться в воде. См. Ниже значения коэффициентов растворимости KNO.3 в 100 г воды при разной температуре:
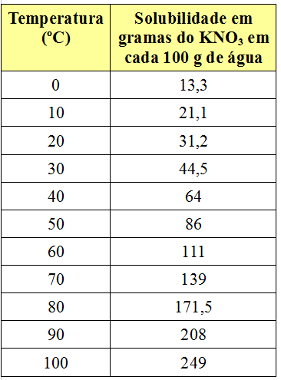
Обратите внимание, что
растворимость содержания этой соли в воде увеличивается с повышением температуры. То же самое и с большинством веществ. Если мы поместим эти значения в графический, у нас будет следующее: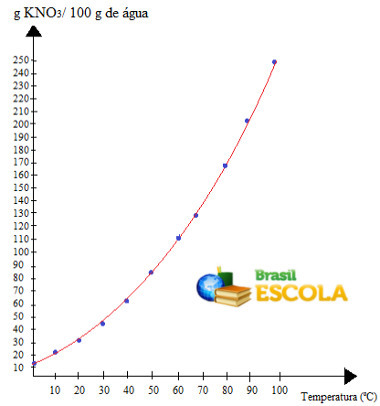
это призыв кривая растворимости НКО3. Мы говорим, что он восходящий, потому что он растет с повышением температуры.
Характеристики кривых растворимости растворенных веществ на графике
У каждого вещества своя кривая растворимости для данного растворителя. Некоторые из этих веществ имеют пониженную растворимость с повышением температуры, как в случае CaCrO4, который имеет кривая растворимости вниз. Это означает, что если мы нагреем насыщенный раствор этой соли, часть растворенной соли выпадет в осадок.
Что касается других веществ, повышение температуры не так сильно влияет на растворимость, как это происходит с раствором поваренной соли (NaCl). При 20 ° C коэффициент растворимости NaCl составляет 36 г в 100 г воды, но если мы увеличим температуру до 100 ° C, эта растворимость увеличится только до 39,8 г, очень небольшое увеличение.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Есть также вещества, в которых растворимость увеличивается только до определенной точки повышения температуры, потому что после этого растворимость уменьшается. Это происходит, например, с гидратированными веществами, которые при нагревании достигают момента обезвоживания. Следовательно, при изменении его состава изменяется и его растворимость с температурой. Это явление можно наблюдать на графике по изгибам кривой растворимости.
Ниже мы представляем график с кривыми растворимости различных веществ:
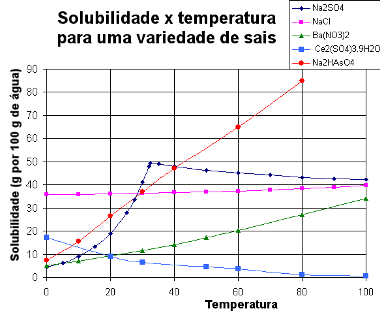
Кривые растворимости различных солей
С помощью этого типа графика мы можем сравнивать растворимость различных солей в одном и том же растворителе и при одинаковых температурах.
Классификация раствора с использованием графика с кривой растворимости
В кривые растворимости они также помогают определить насыщенность растворов, то есть, являются ли они ненасыщенными, насыщенными, фоновыми или перенасыщенными. См. Пример:
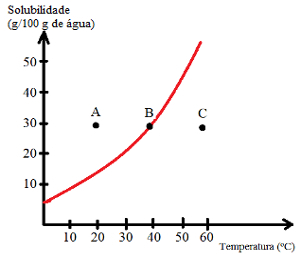
Посмотрите, какие типы решений обозначены точками A, B и C:
A: Пропитанный нижней частью тела. В точке А 30 г растворенного вещества растворяют в 100 г воды при 20 ° C. Кривая показывает, что в этой точке коэффициент растворимости составляет около 15 г / 100 г воды. Таким образом, когда количество присутствующего растворенного вещества больше, получается насыщенный раствор с донным телом.
B: насыщенный. Точка B расположена точно на кривой растворимости, что указывает на то, что раствор насыщен, так как 30 г растворенного вещества растворены в 100 г воды при 40 ° C. Это и есть коэффициент растворимости этого растворенного вещества при данной температуре.
C: ненасыщенный. 30 г растворенного вещества растворено в 100 г воды при 60 ° C. Кривая показывает, что в этой точке коэффициент растворимости превышает 50 г / 100 г воды. Таким образом, поскольку количество растворенного вещества меньше коэффициента растворимости, имеется ненасыщенный раствор.
Таким образом, можно сделать вывод, что:
Точки над кривой: насыщенные растворы с фоновым телом;
Точки на кривой: насыщенные растворы;
Точки под кривой: ненасыщенные растворы.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Графики кривых растворимости»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm. Доступ 28 июня 2021 г.
Химия

Диссоциация и ионизация, итальянский ученый Вольта, электрический ток, шведский физик-химик Свант Август Аррениус, теория Аррениус, положительные ионы, катионы, отрицательные ионы, анионы, едкий натр, поваренная соль, полярные молекулы, диссоциация ионный,


