
Иногда это может случиться с минимальная формула быть такой же, как молекулярная формула соединения; однако это не всегда так.
Например, эмпирическая или минимальная формула для воды - H2О, что указывает на соотношение 2: 1 между элементами, составляющими молекулы воды. По совпадению, это тоже молекулярная формула воды. Однако, чтобы убедиться, что это не всегда происходит, взгляните на два примера ниже:
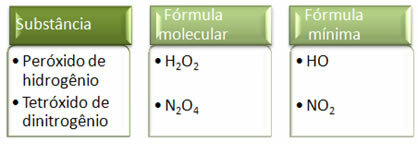
Поскольку минимальная формула - это только соотношение атомов каждого элемента, а не их фактическое количество в молекулярной формуле, это может произойти различных соединений, имеющих одну и ту же эмпирическую формулу, и даже минимальная формула соединения может быть такой же, как молекулярная формула Другие. Обратите внимание, как это может произойти в приведенном ниже примере:
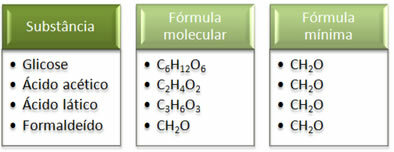
Смотрите, что формула минимума CH2Это одинаково для всех веществ, то есть эта минимальная формула выражает, что во всех случаях атомы углерода, водорода и кислорода присутствуют в молекулярных формулах в соотношении 1:2:1. Кроме того, единственный продукт, имеющий ту же молекулярную формулу, что и эмпирическая формула, - это формальдегид.
- Расчет минимальной или эмпирической формулы:
Чтобы определить эмпирическую формулу соединения, сначала необходимо знать его процентное содержание или приблизительную формулу. Это можно сделать, измерив массу каждого элемента в 100 г образца. Текст "Процентная или сотая формула»Лучше проясняет этот вопрос.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Например, предположим, что приблизительный состав данного соединения определяется следующим образом: 40,00% C, 6,67% H и 53,33% O. Мы передаем эти значения в граммы, учитывая массу 100 г образца компоста. Таким образом, мы имеем: 40 г C, 6,67 г H и 53,33 г O.
Теперь необходимо передать эти значения в количество вещества (моль). Мы делаем это, деля каждое из найденных значений на их соответствующие молярные массы:
С: 40/12 = 3,33
H: 6,67 / 1 = 6,67
О: 53,33 / 16 = 3,33
Поскольку значения не являются целыми числами, мы используем следующий прием: мы делим все значения на наименьшее из них, чтобы пропорция между ними не изменилась.
В этом случае наименьшее значение 3,33, поэтому результат будет:
С: 3,33 / 3,33 = 1
Н: 6,67 / 3,33 = 2
О: 3,33 / 3,33 = 1
Таким образом, минимальная формула этого неизвестного вещества равна: Ç1ЧАС2О1 или же CH2О.
Вкратце, шаги, необходимые для нахождения эмпирической или минимальной формулы вещества:

Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Минимальная или эмпирическая формула»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Доступ 28 июня 2021 г.


