В тексте "Концентрация в моль / л или молярность»Вы видели, что концентрация в моль / л относится к количеству вещества в растворенном веществе (n1, измеряется в молях) с объемом раствора в литрах (В). Однако есть некоторые растворенные вещества, которые при помещении в воду генерируют ионы.
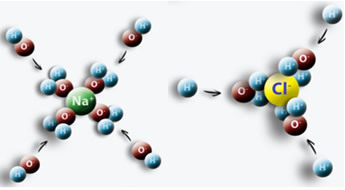
Например, когда мы помещаем соль (NaCl) в воду, возникает притяжение между положительным полюсом воды с Cl и отрицательным полюсом с Na, в результате чего возникают ионы Na.+ и Cl-.
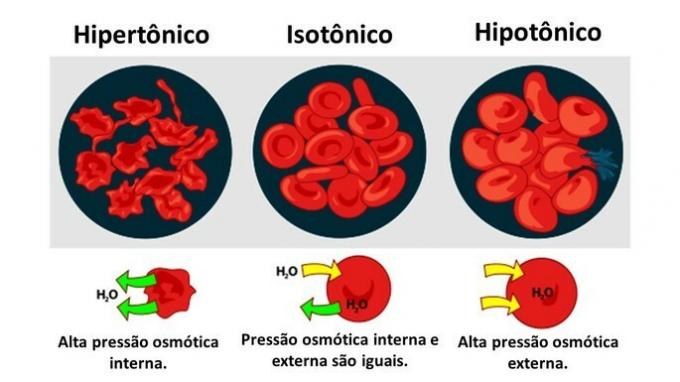
Важно знать, как определить концентрацию этих ионов в моль / л, так как это может быть полезно во многих ситуациях. Одна из областей, где это используется, - это медицина, особенно в медицинских анализах крови. В нашей крови и других жидкостях организма растворены ионы. Если концентрация этих ионов в нашей крови выше или ниже нормы, это может нарушить нормальное функционирование нашего организма и привести к расстройствам и заболеваниям.
См. Случай с ионами железа (Fe2+): если человеку не хватает этого иона, у него может развиться анемия. Таким образом, когда человеку, страдающему анемией, говорят, что ему необходимо употреблять продукты, богатые железом, или даже какое-либо лекарство, содержащее железо, на самом деле это ион железа, а не металлический элемент.
Другой случай - потеря ионов кальция (Ca2+) в костях, вызывая остеопороз, как показано на фотографиях с увеличенными изображениями костей ниже:

Посмотрите на другие примеры ионов, которые выполняют жизненно важные функции в нашем организме и должны быть в правильной концентрации:

Таким образом, с учетом этой информации становится очевидным, что знание того, как рассчитывать концентрацию ионов в растворах, действительно важно. Но как это сделать?
Можно определить концентрации в моль / л ионов, присутствующих в растворах, если известны два важных данных, а именно:
- Формулы веществ, растворенных в воде;
- Молярность ваших решений.
Имея эти данные в руках, напишите уравнение диссоциации или ионизации рассматриваемого растворенного вещества и найдите путем вычитания концентрацию ионов, как он пропорционален количеству молей каждого иона. Это означает, что концентрация ионов пропорциональна их соответствующим коэффициентам в уравнении ионизации или диссоциации.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
См. Следующий пример, чтобы лучше понять, как выполняется этот расчет:
«Учтите, что количественная концентрация данного водного раствора фосфата магния (Mg3(ПЫЛЬ4)2 составляет 0,5 моль / л. Какая будет концентрация в моль / л катионов магния (Mg2+(здесь)) и фосфат-анионы (PO3-4 (водн.)) в этом растворе, учитывая, что степень диссоциации (α) составляла 100%? »
Первый шаг в решении этой проблемы - написать уравнение диссоциации или ионизации. Если у вас возникнут трудности, вы можете использовать приведенное ниже общее уравнение:
1 АИксBу → х А+ y + y B-Икс
1 моль x моль y моль
Итак, учитывая в этом примере, что фосфат магния полностью диссоциировал, мы имеем следующее уравнение:
1 мг3(ПЫЛЬ4)2 (водн.) → 3 мг2+(здесь) + 2 зм3-4 (водн.)
1 моль 3 моль 2 моль
Мы видим, что 1 моль Mg3(ПЫЛЬ4)2 дает 3 моль Mg2+(здесь) и 2 моль ПО3-4 (водн.); таким образом, количество молей катиона будет в 3 раза больше количества молей фосфата, с которым был приготовлен раствор, а количество анионов будет в 2 раза.
Поскольку раствор 0,5 моль / л Mg3(ПЫЛЬ4)2 (водн.) , это означает, что 0,5 моль Mg было растворено в 1 л его.3(ПЫЛЬ4)2, что дало 1,5 моль / л Mg2+(здесь) и 1,0 моль / л ПО3-4 (водн.):
1 мг3(ПЫЛЬ4)2 (водн.) → 3 мг2+(здесь) + 2 зм3-4 (водн.)
1 моль 3 моль 2 моль
0,5 моль x y
1. 0,5 3. 0,5 2. 0,5
0,5 моль / л 1,5 моль / л1,0 моль / л
Но что, если степень диссоциации или ионизации не была 100%? Скажем, это было 70%, как бы нам узнать концентрацию этих ионов в моль / л?
В таком случае просто выполните простое правило трех. См. ниже:
1,5 моль / л Mg2+(здесь) 100 %
х 70%
х = 70. 1,5 → x = 1,05 моль / л ионов Mg2+(здесь)
100
1,5 моль / л ПО3-4 (водн.) 100 %
y 70%
y = 70. 1,0 → y = 0,70 моль / л ионов ПО3-4 (водн.)
100
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Концентрация ионов в моль / л»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. Доступ 28 июня 2021 г.
Химия

Диссоциация и ионизация, итальянский ученый Вольта, электрический ток, шведский физик-химик Свант Август Аррениус, теория Аррениус, положительные ионы, катионы, отрицательные ионы, анионы, едкий натр, поваренная соль, полярные молекулы, диссоциация ионный,