Соляная кислота гидрокислота с высоким потенциалом ионизации, это желтоватая жидкость, очень едкая и токсичная. Он используется в различных промышленных процессах, таких как производство чистящих средств и фармацевтических гидрохлоридов, в пищевых продуктах и в процессах производства стали.
Он также присутствует в организме человека; О желудочный сок который действует в переваривании белки кислотный раствор; соляной и других веществ, таких как ферменты а также соли. Воздействие, вдыхание или проглатывание концентрированная соляная кислота очень вредна для здоровья, что может даже привести к смерти.
Читайте тоже: Серная кислота - вещество, обладающее высокой коррозионной способностью.
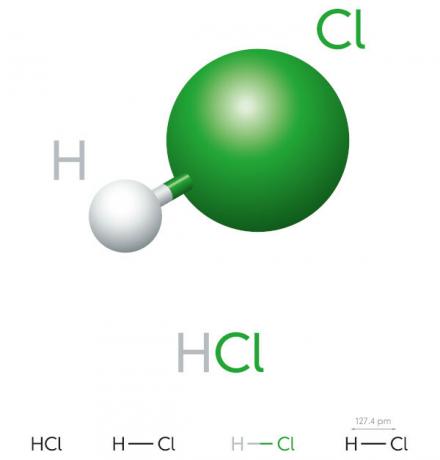
Свойства соляной кислоты
- неорганическое соединение
- сильная кислота
- Высокий потенциал ионизации
- Жидкость
- желтоватый вид
- Токсичный
- Едкий
- Летучий
- Гигроскопичен (имеет свойство впитывать áвода окружающей среды)
- Растворим в воде
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Производство соляной кислоты
Соляная кислота была обнаружен мусульманским алхимиком звали Джабир Ибне Хайане, также известный как Габер и считающийся отцом арабской химии. Он синтезировал вещество на основе реакция между морской солью (NaCl) и серная кислота (В2ТОЛЬКО4).
2NaCl + H2ТОЛЬКО4 → В2ТОЛЬКО4 + 2HCl
В настоящее время соляная кислота производится в больших масштабах за счет электронныйóлизис натрия хлорида в водном растворе. В результате этого процесса получается газ. хлор (Cl2), газ водород (H2) и гидроксид натрия (NaOH). Газы хлора и водорода реагируют с образованием соляной кислоты:
Cl2 + H2 → 2HCl
Тем не мение, эта реакция чрезвычайно экзотермический и очень опасно. В настоящее время большая часть производимой в промышленности соляной кислоты связана с производством органических соединений, что является более экономичным и безопасным процессом.
R-H + Cl2 → R-Cl + HCl
(Считайте R органическим радикалом.)
Смотрите также: Советы по определению-если сила кислот

Применение соляной кислоты
- Травление металла: Соляная кислота используется для «очистки» металлов перед их обработкой, удаления ржавчины, окалины и других загрязнений с их поверхности.
- Производство органических соединений: соляная кислота используется в качестве реагента для получения винилхлорида, который используется при производстве пластмасс. Соляная кислота также происходит из хлоропрена, который используется в синтетических каучуках.
- Производство неорганических соединений: соляная кислота присутствует в нескольких промышленных процессах производства реагентов и соединений. неорганические вещества, среди них продукты для очистки воды, такие как хлорид железа (III) и алюминий.
- Используется как чистящее средство: Также продается как соляная кислота, соляная кислота используется для пост-строительной, бытовой и химической очистки инструментов и оборудования.
- Переработка пищевых продуктов: Соляная кислота используется в различных реакциях производства пищевых продуктов и добавок, таких как гидролиз крахмала и белков, или в конечном продукте для поддержания баланса pH.
- Производство лекарств: Соляная кислота используется в производстве растворимых гидрохлоридов, присутствующих в нескольких лекарствах, таких как гидрохлорид доксициклина, используемый для лечения брюшной тиф а также оспа.
Соляная кислота в организме
Соляная кислота присутствует в нашем пищеварительная система, желудочный сок, производимый нашим желудком, представляет собой раствор воды, ферментов, соляной кислоты, неорганических солей и небольшого процента молочной кислоты.
О пищевой пирог превращается в химус, кислая масса (благодаря действию желудочного сока и его кислому составу), это когда переваривание белки, превратился в полипептиды а также аминокислоты которые будут поглощены телом.
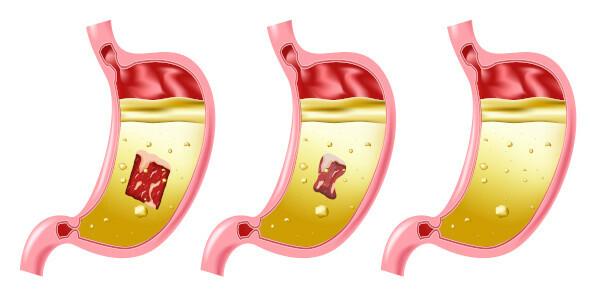
Опасности, связанные с соляной кислотой
Соляная кислота - очень сильная и едкая кислота, поэтому контакт с веществом вызывает несколько повреждений:
- Кожа: Вызывает ожоги и раздражение.
- Глаза: Вызывает сильное раздражение и может вызвать слепоту.
- Вдыхание: Вызывает раздражение и повреждение верхних дыхательных путей.
- проглатывание: вызывает коррозию всей ротовой системы и желудочно-кишечного тракта, может вызвать рвоту, кровотечение, диарею, проблемы с кровообращением, что может привести к смерти.
- Экспозицияпродолжение следует: сначала поражает слизистую оболочку, вызывая дерматит и конъюнктивит, кровоточивость десен, фотосенсибилизация; частое вдыхание, даже при низкой концентрации соединения, может вызвать гастрит и кровотечение из носа.
Также доступ: Характеристики и свойства уксусной кислоты

решенные упражнения
Вопрос 1 - (Udesc) Что касается соляной кислоты, можно сказать, что:
А) в водном растворе пропускает электрический ток.
Б) представляет собой двухосновную кислоту.
C) - слабая кислота.
Г) имеет низкую степень ионизации.
E) - ионное вещество.
разрешение
Альтернатива А. Соляная кислота не является двухосновной кислотой, поскольку имеет только один ионизируемый H, но один сильная кислота, молекулярное вещество с высоким потенциалом ионизации. THE ионизация в водной среде способствует проведению электрический ток из-за наличия свободных ионов.
Вопрос 2 - В растворе соляной кислоты и воды можно сказать, что появление молекулярного хлористого водорода (HCl) минимально, потому что
А) соляная кислота при контакте с водой разбавляется.
Б) Хлороводород - это вещество, не растворяющееся в воде.
В) хлористый водород имеет высокий потенциал ионизации, поэтому в водной среде молекула HCl образует ионы H+ Cl-.
Г) соляная кислота, так как она очень летучая, отделяется от раствора, оставляя только молекулы воды.
Д) соляная кислота - ионное вещество, поэтому в водном растворе диссоциирует, образуя ионы.
разрешение
Альтернатива C.
А) Ответ не согласуется с вопросом, разбавление соляной кислоты в воде не оправдывает отсутствие молекулярной HCl.
Б) Неправильно, хлористый водород растворим и имеет сродство к воде.
В) Правильно
D) Хотя соляная кислота является летучей, это разделение двух компонентов в растворе не происходит значительно.
E) Соляная кислота - это раствор хлористого водорода и воды, где хлористый водород является неионным молекулярным веществом.
Лайса Бернардес Маркес де Араужо
Учитель химии
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
ARAúJO, Лайса Бернардес Маркес де. "Соляная кислота"; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Доступ 27 июня 2021 г.