Атомы - это бесконечно маленькие частицы, из которых состоит вся материя Вселенной. Со временем представление о том, как будет выглядеть атомная структура, изменилось в соответствии с новыми открытиями, сделанными учеными. Подробнее об этом можно узнать в текстеЭволюция атомной модели.
Модель - это представление реальности (а не сама реальность), поэтому атомные модели - это представления основные компоненты атома и его структура и объясняют определенное физическое и химическое поведение вещества. Это сделано потому, что человек еще не может увидеть изолированный атом даже в ультрамикроскоп.
Чтобы понять, насколько мал атом, знайте, что В Самая маленькая частица, видимая в обычный микроскоп, содержит более десяти миллиардов атомов! Атом настолько мал, что, если мы поставим миллион из них рядом, мы не достигнем толщина волоса.
Интеллектуальная карта: Атом
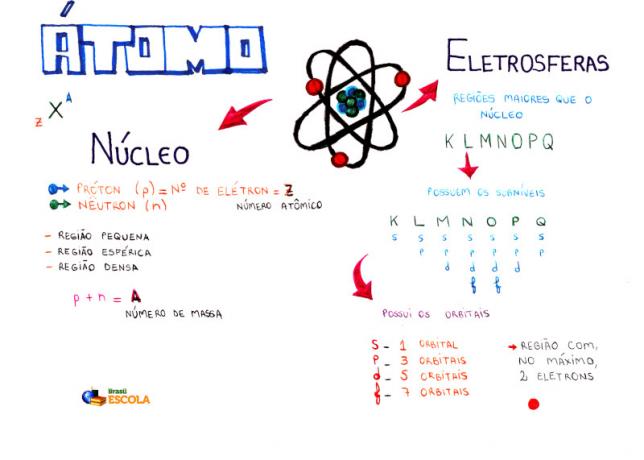
* Чтобы скачать интеллектуальную карту в формате PDF, кликните сюда!
Среди атомных моделей наиболее часто используемой в настоящее время в средней школе для понимания структуры атома и его свойств является модель Резерфорда-Бора. Согласно этой модели, структура атома состоит из двух основных частей:
основной и электросфера.
Две основные части строения атома - электросфера и ядро.
* Основной: Являясь центральной частью атома, он компактный, массивный и очень плотный, помимо того, что он образован частицами большей массы, которые являются протонами и нейтронами.

Иллюстрация протонов и нейтронов, составляющих атомное ядро
- Протоны: это частицы с положительным электрическим зарядом (относительный заряд = +1; заряд в кулонах (Кл) = +1,602. 10-19) и его относительная масса равна 1.
Тот факт, что протоны образуют ядро и придают ему общий положительный заряд, был обнаружен Евгений Гольдштейн, в 1886 г. путем модификации ампулы Крукса и некоторых экспериментов. Он увидел, что при очень высоких напряжениях появляются эмиссии (анодные лучи - остатки атомов газа, которые находились внутри колбы, и их электроны были оторваны электрическим разрядом). Помещая электрическое или магнитное поле вне колбы, эти лучи отклонялись к отрицательному полюсу. Это означало, что существуют положительные субатомные частицы, которые называются протонами.
Позже, Эрнест Резерфорд (1871-1937) провел эксперимент, описанный в тексте Атом Резерфорда, что привело его к открытию местонахождения протона: в ядре.
- Нейтроны: это частицы с массой, равной массе протонов (1), но, как следует из названия, они нейтральны, то есть не имеют электрического заряда.
Нейтроны были открыты в 1932 г. Джеймс Чедвик (1891–1974), который понял, что ядро радиоактивного бериллия испускает нейтральные частицы с массой, примерно равной массе протонов (на самом деле, она немного больше).
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Диаметр ядра зависит от количества протонов и нейтронов, которые есть в атоме, но в среднем он составляет около 10-14 10 месяц-15 м.
Ядро атома концентрирует практически всю массу атома, являясь очень небольшой частью: и протон, и нейтрон примерно в 100 000 раз меньше самого атома! Для сравнения представьте, что мы увеличиваем ядро атома элемента водорода (который имеет только протона) до размера теннисного мяча, ближайший электрон будет примерно в трех километрах от расстояние! Даже если бы атом был увеличен до высоты 14-этажного здания, его ядро было бы размером с крупицу соли на седьмом этаже. Это действительно что-то удивительное, не правда ли ?!
* Электросфера: Является область, где электроны вращаются вокруг ядра. Несмотря на то, что это область гораздо большего объема, чем ядро, она практически пуста, поскольку каждый электрон в 1836 раз меньше 1 протона (или 1 нейтрона). Вот почему практически вся масса атома находится в ядре. Электроны - это частицы с отрицательным электрическим зарядом (-1).
Электроны были открыты в 1897 г. Джозеф Джон Томсон (1856-1940), создатель Атомная модель Томсона. Подробно эксперимент Томсона можно увидеть в тексте. Эксперимент Томсона с электрическими разрядами, но короче говоря, он использовал вышеупомянутую ампулу Крукса и понял, что катодные лучи всегда привлеченный положительным полюсом, что доказало наличие в атоме отрицательных частиц, которые были названы электроны.
Электроны вращаются вокруг ядра миллиарды раз за миллионную долю секунды, формируя атом и заставляя его вести себя так, как если бы он был твердым.
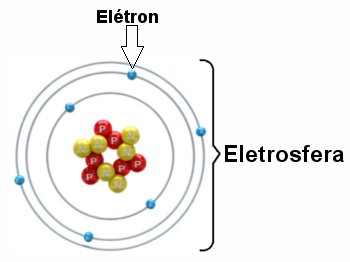
Иллюстрация электросферы с тремя электронными слоями и электронами, вращающимися вокруг ядра.
Вкратце, мы можем составить таблицу, чтобы различать три основных субатомных частицы, которые являются частью структуры атома:

Масса и электрический заряд трех основных субатомных частиц - протонов, нейтронов и электронов.
Атомы всех химических элементов состоят из этих трех субатомных частиц. Что отличает один химический элемент от другого, так это количество, в котором появляются эти частицы, особенно количество протонов в ядре, которое называется атомным номером. Продолжайте изучать это через текст. Химический элемент.
* Ментальная карта. Автор: Диого Лопес.
Дженнифер Фогача
Окончила химический факультет
Химия
Классификация веществ, вода, синильный газ, углекислый газ, аммиак, водород, гелий, вещества. простые, сложные вещества, смеси, фазы смеси, гомогенная смесь, смесь неоднородный.