THE ecuația clapeyron este o expresie matematică care raportează cantități precum presiune (P), volumul (V), temperatura (T) și numărul de particule (n) care alcătuiesc a gaz perfect sau ideal. Această ecuație poartă numele fizicianului francez Paulemileclapeyron și poate fi înțeles ca o generalizare a legilor empirice ale gazeperfectînGay-Lussac, Charles și Boyle. A fost fundamental pentru studiul gazelor ideale și a permis evoluția Mașini termice, făcându-le din ce în ce mai eficiente în ultimele decenii.
Vezi și: Descoperiri fizice care s-au întâmplat prin accidente
Ecuația lui Clapeyron: legea ideală a gazelor
Ecuația lui Clapeyron este derivat din trei legi empirice, adică legi care au fost determinate din experimente. Astfel de legi explică comportamentul gazelor în transformări de gazeizovolumetric (Legea Gay-Lussac), izobaric (Legea lui Charles) și izoterme (Legea lui Boyle). Conform acestor legi:
în transformări izovolumetric, raportul dintre presiune și temperatura termodinamică a unui gaz ideal rămâne constant;
în transformări izobaric, raportul dintre volumul și temperatura termodinamică a unui gaz ideal este constant;
- în transformări izoterme, produsul presiunii și volumului unui gaz ideal rămâne constant.
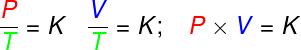
P - presiune (Pa - pascal)
V - volumul gazului (m³)
T - temperatura gazului termodinamic (K - kelvin)
Din cele trei legi de mai sus, ecuația Clapeyron determină care este valoarea acesteia constant (K) obținute în fiecare dintre transformările menționate mai sus. Conform ecuației lui Clapeyron, această constantă este egală cu numărul de moli înmulțit cu a constantă R, cunoscută sub numele de constanta universală a gazelor ideale și egală cu Constanta Boltzmann înmulțit cu Numărul lui Avogadro.
Formulă
Verificați formula cunoscută sub numele de ecuaţieînClapeyron:
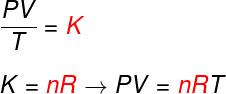
Nu - numărul de moli (mol)
R - constanta universală a gazelor ideale (R = 0,082 atm.l / mol. K sau 8.314 J.mol / K)
Analizând ecuația Clapeyron, este posibil să vedem că presiune exercitat de gazele ideale este direct proporțională cu temperatura și, de asemenea, la numărul de alunițe. În plus, presiunea este invers proporțională cu volumul ocupat de gaz.
O model de gaz ideal făcut posibil de ecuația Clapeyron este utilizat pe scară largă pentru dezvoltarea de mașini alimentate de lichide, cum ar fi mașinile alimentate cu abur și motoarele cu ardere internă.
Mai multe rezultate importante ar putea fi obținute din ecuația Clapeyron. Unul dintre ei, de exemplu, prezice că 1 mol din orice gaz ideal ocupă un volum de 22,4 l când este supus presiunii de 1 atm (1,01.105 Pa) și la temperatura de 273K (0 ° C).
Vezi și: Cele mai importante concepte în termologie
Exerciții rezolvate despre ecuația Clapeyron
Întrebarea 1 - (UECE) Un gaz care poate avea temperatura, volumul și presiunea legate de PV = nRT are următoarele caracteristici:
a) distanță medie foarte mare între molecule pentru a ignora interacțiunile intermoleculare, cu excepția cazului în care se ciocnesc; moleculele suferă coliziuni elastice.
b) distanță medie foarte mică între molecule; moleculele suferă coliziuni inelastice.
c) distanță medie foarte mare între molecule pentru a ignora interacțiunile intermoleculare, cu excepția cazului în care se ciocnesc; moleculele suferă coliziuni inelastice.
d) distanță medie foarte mare între molecule și cu interacțiuni intermoleculare puternice; moleculele suferă coliziuni elastice.
Rezoluţie:
În modelul ideal de gaz, un număr mare de particule adimensionale se mișcă cu viteză mare în direcții aleatorii. Singura interacțiune suferită de aceste particule sunt coliziuni perfect elastice, deci alternativa corectă este litera a.
Întrebarea 2 - (UFRGS) Luați în considerare următoarele afirmații despre gazele ideale.
I. Constanta R prezentă în ecuația de stare pentru gazele pV = nRT are aceeași valoare pentru toate gazele ideale.
II. Volumele egale ale diferitelor gaze ideale, la aceeași temperatură și presiune, conțin același număr de molecule.
III. Energia cinetică medie a moleculelor unui gaz ideal este direct proporțională cu temperatura absolută a gazului.
Care sunt corecte?
a) Doar eu
b) Doar II
c) Numai III
d) Doar I și II
e) I, II și III
Șablon:
Să analizăm alternativele:
I. corect, de aici se numește constanta universală a gazelor ideale.
II. corect. Conform ecuației lui Clapeyron, dacă două gaze ideale au aceeași presiune, temperatură și volum, atunci numărul de particule din aceste gaze este egal.
III. corect. Conform teoremei de echipare a energiei, energia cinetică a particulelor dintr-un gaz ideal este proporțională cu temperatura sa.
Prin urmare, alternativa corectă este litera e.
Întrebarea 3 - (UFJF) Bărbați precum Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, printre alții, au dezvoltat studii importante care implică proprietățile gazelor. Comportamentul gazelor reale se apropie de gazele ideale la condiții de presiune scăzută, precum și de gazele conținute într-un volum mare și gazele menținute la temperaturi ridicate. Luați în considerare faptul că, într-un experiment de laborator, un recipient cu volumul V complet închis și conținând 1 mol de gaz ideal sub o presiune de 4,0 atm este supus unei expansiuni la o temperatură constantă egală cu 127 ° C și că comportamentul acestui gaz este cel al unui gaz ideal, așa cum se arată în grafic.
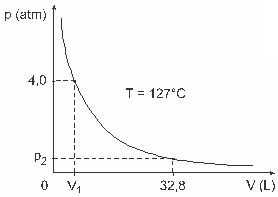
În acest caz, când gazul ocupă un volum egal cu 32,8 L, presiunea exercitată de acesta va fi:
(Dat fiind: constanta universală a gazelor perfecte este R = 0,082 atm. L / mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Rezoluţie:
Litera C.
Pentru a rezolva exercițiul, trebuie să aplicăm datele ecuației Clapeyron, dar înainte de aceasta trebuie să transformăm temperatura, care este în grade Celsius, în grade kelvin. Verifică:

De Rafael Hellerbock
Profesor de fizică
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm
