Conform primei legi a termodinamicii, în orice proces termodinamic cantitatea de căldură Î primit de un sistem este egal cu munca depusă de acesta plus variația energiei sale interne.
Când presiunea este constantă, căldura schimbată de sistem cu mediul extern este utilizată pentru lucru și pentru a schimba energia internă. În multe situații practice, sistemele sunt supuse presiunii atmosferice, ca în cazul unei reacții chimice. Figura de mai sus prezintă diagrama PV a acestui tip de proces.
În acest caz, în ecuația primei legi,
Q = τ + ∆U
niciunul dintre termeni nu este zero. Lucrarea este scrisă în funcție de variația volumului volum V, cum ar fi:
τ = P.∆V
Pentru cazul particular al unui gaz monoatomic ideal, energia poate fi scrisă după cum urmează:

Prin urmare, putem scrie Prima lege a termodinamicii în funcție de ΔV:


Căldura schimbată cu mediul este (5/2) P.ΔV, iar 40% din total - care corespunde P.ΔV - este folosit pentru efectuarea lucrărilor; și (3/2) P.ΔV, care corespunde cu 60% din total, sunt utilizate pentru a modifica energia internă. Acest rezultat este valabil pentru un gaz monoatomic ideal.
Căldura este legată de variația temperaturii (folosind legea ideală a gazelor) prin:
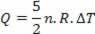
Astfel, căldura furnizată poate fi calculată prin schimbarea temperaturii sau prin schimbarea volumului.
De Domitiano Marques
Absolvent în fizică
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm

