Acizi sunt substanțe care ionizează în mediu apos și sunt bune dirijori putere. Aciditatea unei substanțe poate fi măsurată prin tehnici de măsurare a potențialului hidrogen ionic (pH) a unei soluții. Unele metode analitice ale pH-ului utilizează indicatori precum turnesol sau fenolftaleină, care reflectă valoarea pH-ului soluției în culoare.
Acizii pot fi caracterizați:
prin prezența sau nu a oxigenului în molecula sa;
cu forta;
de hidrogeni ionizabili;
prin volatilitatea sa.
Citește și:Comparație între acizi și baze - diferențe și proprietăți
Caracteristicile acizilor
Se ionizează într-un mediu apos, eliberând cationul H.+.
Sunt conductori de electricitate datorită eliberării de ioni într-un mediu apos.
În contact cu mediul de bază, suferă reacție de neutralizare, formând sare și apă ca produse ale acestei reacții.
Acestea schimbă culoarea soluției în prezența unei substanțe indicatoare, cum ar fi turnesol sau fenolftaleină.
Aroma acră a lămâii, portocalei, printre alte citrice, se datorează acidului prezent în aceste alimente.
Potențial de hidrogen (pH)
Potențialul ionului hidrogen (pH) este un calcul care exprimă concentrația de ioni de hidrogen într-un anume soluţie. Pentru determinarea pH-ului și analiza mediului, se iau în considerare următoarele:
Legea diluției lui Ostwald (cu cât se diluează, cu atât se vor forma mai mulți ioni în soluție);
autoionizarea apei (Kw), care este defalcarea naturală a moleculei H.2O în ioni H+ și oh-;
apa distilată la 25 ° C are autoionizare Kw = 10-14 și aceeași concentrație de ioni H+ și oh-, adică este un mediu neutru.
Pentru calculul pH-ului care implică concentrația de H+, utilizare: pH = -log [H+].
Să știți că:
pH> 7 → soluție bazică
pH <7 → soluție acidă
pH = 7 sau pH = pOH → soluție neutră
Vezi și: Cum sunt formulele acide?

Clasificarea acizilor
THE clasificarea acidului se poate face luând în considerare patru criterii diferite.
Gradul de ionizare (α) sau puterea acidă
α = numărul de molecule ionizate
numărul de molecule dizolvate
Acizi tari: α ≥ 50%.
Exemplu: áacid sulfuric (H2NUMAI4) → α = 61%.Acizi semi-puternici sau moderati: 5% < α < 50%.
Exemplu: acid fosforic (H3PRAF4) → α = 27%.Acizi slabi: α ≤ 5%.
Exemplu: acid boric (H3BO3) → α = 0,075%.
→ Numărul de hidrogen ionizabil
monoacid: eliberează un cation H.+.
Exemplu: áacid clorhidric (ACID CLORHIDRIC);
diacid: eliberează doi cationi H+.
Exemplu: hidrogen sulfurat (H2S).Triacid: eliberează trei cationi H+.
Exemplu: acid boric (H3BO3).tetracid: eliberează patru cationi H+.
Exemplu: acid pirofosforic (H4P2O7).
Atenţie! În cazul hidracizilor, toți hidrogenii din moleculă sunt ionizabili; dar în cazul oxiacizilor, numai hidrogenii care sunt legați de un atom de oxigen sunt ionizabili. Un exemplu este acidul hipofosforos (H3PRAF2), care este un monoacid deoarece, în ciuda faptului că are trei hidrogeni în compoziția sa, eliberează doar hidrogenul care este legat de oxigen.
→ Prezența oxigenului
oxiacizi: au oxigen în structura lor.
Exemplu: acid hipocloros (HO Cl).
Hidracide: nu au oxigen în structura lor.
Exemplu: acid fluorhidric (HF).
→ Volatilitate
Fix: Punct de fierbere(PICIOR) > 100 ° C, trecând încet la o stare gazoasă.
Exemplu: acid sulfuric (H2NUMAI4) → PE = 340 ° C.volatile: punctul de fierbere <100 ° C, trecând rapid și ușor la o stare gazoasă.
Exemplu: hidrogen sulfurat (H2S) → PE = -59,6 ° C.
Nomenclatura acidă
→ Hidracide
Acid + denumire anion + hidric
Pentru toți acizii, termenul „acid” este folosit înainte de nomenclatura care caracterizează molecula. În hidracizi, sufixul „eto” al numelui elementului este înlocuit cu „hidric”.
Exemple:
HCl → acid clorhidrică
HBr → acid bromhidrică
HF → acid fluorhidrică
→ oxiacizi
Nomenclatura oxiacidelor variază în funcție de număr de oxidare (NOX) a elementului central. Vezi tabelul de mai jos:
NOX al elementului central |
Nomenclatura acidă |
||
prefix- |
-infix- |
-sufix |
|
+1 și +2 |
Hipopotam |
-nume de anion- |
-oso |
+3 și +4 |
-- |
Numele anionului- |
-oso |
+5 și +6 |
-- |
Numele anionului- |
-IC |
+7 |
Pe |
-nume de anion- |
-IC |
Exemple:
HClO → Știind că hidrogenul (H) are în mod normal NOX +1 și oxigenul (O) are NOX -2, pentru ca noi să avem o moleculă de sarcină 0, clorul (Cl) trebuie să aibă NOX +1, deci nomenclatura acestui acid este acid hipocloros.
HNO2 → acid azotat
HClO4 →áacidpercloric
→ Excepții de la regulă
H2CO3 → acid carbonic, și nu carbonacee, așa cum ar fi sub regula NOX.
H3BO3 → áacid boric, și nu boros.
Acizi în viața de zi cu zi
Îngrășăminte și medicamente: Acid fosforic (H3PRAF4) este utilizat pe scară largă la fabricarea îngrășămintelor și, de asemenea, ca medicament. Este unul dintre mai mulți acizi care sunt utilizați în domeniul farmaceutic.
Citrice: au acid ascorbic (C6H8O6), de asemenea cunoscut ca si Vitamina C.
Oţet: are în compoziția sa Acid acetic (CH3COOH).
- Apă spumantă și băuturi răcoritoare: compus din acid carbonic (H2CO3), care conferă produsului o senzație răcoritoare.
De asemenea, accesați:Rolul acizilor în băuturile răcoritoare

exerciții rezolvate
Intrebarea 1 - (Enem) Sucul extras din varza roșie poate fi folosit ca indicator al caracterului acid (pH între 0 și 7) sau bazic (pH între 7 și 14) al diferitelor soluții. Amestecând puțin suc de varză și soluția, amestecul începe să arate diferite culori, în funcție de natura sa acidă sau bazică, în conformitate cu scara de mai jos.
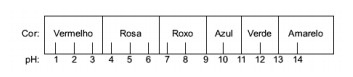
Unele soluții au fost testate cu acest indicator, producând următoarele rezultate:
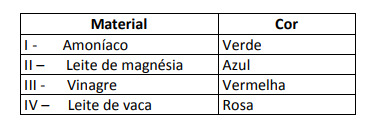
Conform acestor rezultate, soluțiile I, II, III și IV au, respectiv, următorul caracter:
A) acid / bazic / bazic / acid.
B) acid / bazic / acid / bazic.
C) bazic / acid / bazic / acid.
D) acid / acid / bazic / bazic.
E) Bazic / Bazic / Acid / Acid.
Rezoluţie
Alternativa E. Pentru a determina dacă substanța are un caracter acid, bazic sau chiar neutru, se efectuează o analiză a culorilor obținute în test în raport cu datele scalei date. Știind că soluțiile cu pH = 7 sunt neutre, pH> 7 sunt bazice și cu pH <7 sunt acide, ajungem la concluzia că amoniacul și laptele de magnezie sunt substanțe de bază, iar oțetul și laptele de vacă acizi.
Intrebarea 2 - (PUC-Camp) În ceea ce privește substanțele numite acizi, un student a notat următoarele caracteristici:
Eu - am putere corozivă;
II - sunt capabili să neutralizeze bazele;
III - sunt compuse din două elemente chimice;
IV - formează soluții apoase care conduc curentul electric.
A făcut greșeli DOAR în
A) I și II
B) I și III
C) I și IV
D) II și III
E) III și IV
Rezoluţie
Alternativa B. Nu toți acizii sunt corozivi, doar cei mai puternici, iar acizii pot fi compuși din doi sau mai mulți atomi.
de Laysa Bernardes
Profesor de chimie


