Enzime sunt catalizatori biologici responsabili de creșterea vitezei unei reacții chimice date. Enzimele sunt de obicei proteine, dar există unele acizi ribonucleici care acționează ca enzime, fiind numite ribozime.
Pentru a accelera o reacție, enzimele trebuie să se lege de reactivi, care sunt cunoscuți ca substraturi. Pentru o lungă perioadă de timp, această legătură a fost considerată a fi destul de rigidă, un model cunoscut sub numele de blocare a cheii. pentru moment, In orice caz, este acceptat modelul cunoscut sub numele de montaj indus., care presupune că apar modificări ușoare sub forma enzimei pe măsură ce substratul intră în situsul activ.
Citește și: Ce este metabolismul?
Ce sunt enzimele?
Enzimele sunt biomolecule care acționează ca catalizatori, adică sunt substanțe capabile să accelereze viteza reacții chimice care apar la ființele vii fără a fi consumate în timpul acestor reacții. Fără acțiunea enzimelor, unele reacții ar fi foarte lente, ceea ce ar dăuna metabolismului. Enzimele accelerează selectiv reacțiile și, prin urmare, sunt catalizatori foarte specifici.
Enzimele sunt capabile să accelereze o reacție prin scăderea energiei de activare, adică reduc cantitatea de energie care trebuie adăugată pentru a începe o reacție.
[publication_omnia]
Fiecare enzimă este o proteină?
Deși sunt adesea definite ca catalizatori biologici de natură proteică, nu orice enzimă este o proteină. Există unele ARN-uri care funcționează ca enzime, numite ribozime. Majoritatea enzimelor, însă, sunt proteine, fiind formate, prin urmare, de aminoacizi. Compoziția de aminoacizi a acestor biomolecule definește structura tridimensională pe care o va dobândi.
Citește și: Cum acționează substanțele catalizatoare?
Complex enzimatic-substrat
Se numește substrat reactiv asupra căruia acționează o enzimă. Când o enzimă se leagă de substratul său, complexul se formează enzimă-substrat. Această legare are loc într-o anumită regiune, numită sit activ.
Când vorbim despre enzime pe bază de proteine, situsul activ corespunde doar câtorva aminoacizi, restul moleculei fiind responsabil pentru determinarea configurației situsului activ. Forma sitului activ, precum și forma substratului sunt legate de specificitatea enzimei, deoarece acestea trebuie să fie complementare.
Model cu cheie
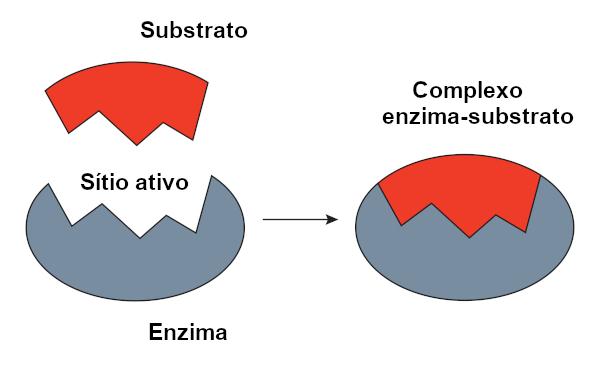
O model de blocare a cheii, propus de Emil Fischer, este utilizat pe scară largă pentru a explica interacțiunea dintre enzimă și substrat. Conform acestui model, există o complementaritate rigidă între enzimă și substrat, la fel ca o cheie și o încuietoare. Situl activ al enzimei ar avea o formă complementară substratului, care s-ar potrivi perfect. Prin urmare, alte molecule nu ar avea acces la acest site, ceea ce ar garanta specificitatea enzimei. Așa cum o cheie deschide doar o încuietoare, o enzimă se va lega doar de un substrat. Astăzi știm totuși că acest lucru modelul nu este corect, deoarece enzimele nu sunt structuri rigide așa cum se credea anterior.
Model de montaj indus
În prezent, cel mai acceptat model pentru a explica legătura dintre o enzimă și substratul acesteia este cea a trage induse, propus inițial de Koshland și colab. Site-ul activ și substratul nu funcționează rigid ca o cheie și un blocaj. Cercetările arată că, pe măsură ce substratul pătrunde în situsul activ, enzima suferă o ușoară modificare, ceea ce favorizează potrivirea dintre situsul activ și substrat. Pentru a înțelege mai bine acest model, ne putem gândi la interacțiunea dintre enzimă și substrat ca o strângere de mână, care devine mai fermă după primul contact.
Cofactori
Majoritatea enzimelor au nevoie de molecule auxiliare pentru a-și desfășura acțiunea catalitică, numite cofactori. Cofactorii pot fi atașați permanent de enzimă sau pot fi atașați slab și reversibil de substrat. Ei, de asemenea pot fi anorganice sau organice. Când cofactorii sunt molecule organice, acestea se numesc coenzime.
niste vitamine acționează ca coenzime, acesta fiind cazul, de exemplu, al riboflavinei, cunoscută și sub numele de vitamina B2. Ca exemple de cofactori anorganici, putem menționa fierul și zincul în forma lor ionică.
Citește și: Vitamine din complexul B - un grup de vitamine care acționează în general ca coenzime
Clasificarea enzimelor
Enzimele pot fi clasificate în șase grupuri, folosind ca criteriu tipul de reacție pe care îl catalizează.
Oxidoreductaze: enzime legate de reacțiile de oxirreducere.
Transferaze: catalizează transferul grupurilor de la un compus la altul.
Hidrolaze: catalizează reacțiile de hidroliză.
Liasuri: acționează adăugând grupuri la legături duble sau îndepărtând grupuri care formează o legătură dublă.
Izomeraze: catalizează reacțiile de izomerizare.
Link-uri: enzime care provoacă degradarea moleculei de ATP, folosind energia eliberată în această reacție pentru a forma noi compuși.
Factori care reglează activitatea enzimei
Activitatea unei enzime este influențată de factori, principalii fiind temperatura și pH. Temperatura joacă în general un rol pozitiv în reacțiile chimice, crescând viteza unei reacții enzimatice. Cu toate acestea, atunci când temperatura crește peste condițiile optime, viteza de reacție scade considerabil. Acest lucru se datorează faptului că se observă denaturarea proteinelor. Majoritatea enzimelor umane au o temperatură optimă între 35 și 40 ° C. În plus față de temperatură, pH influențează și activitatea enzimatică și există și o valoare optimă. Pentru majoritatea enzimelor, valoarea optimă a pH-ului este cuprinsă între 6 și 8.
De Vanessa Sardinha dos Santos
Profesor de biologie
