La forte intermoleculare, numit generic Forțele Van der Waals, se află trei: dipol indus de dipol, legături de hidrogen și dipol permanent-dipol permanent. În acest text, vom lua în considerare doar ultima dintre aceste trei forțe:
Puterea dipol permanent-dipol permanent, sau pur și simplu, dipol-dipol apare numai în molecule polare, adică cele care nu au o distribuție uniformă a sarcinii de-a lungul suprafeței sale. Pentru a cita un exemplu, în molecula de HCl (gaz clorhidric) norul electronic este mai deplasat spre atomul de clor, deoarece este mai electronegativ decât hidrogenul.
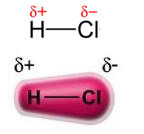
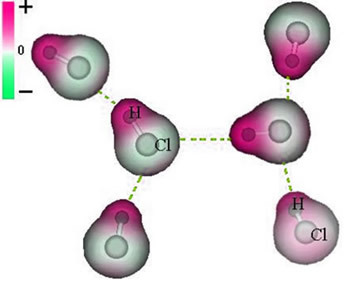
Rețineți că în jurul atomului de clor există o acumulare de electroni, care determină formarea unui pol negativ, care este simbolizat prin litera greacă delta (-δ). Ca urmare, în regiunea din jurul atomului de hidrogen a pol pozitiv (+δ), deoarece are densitate electronică scăzută. Molecula de HCl constituie apoi a dipol electric și, prin urmare, atunci când intrați în contact cu alte molecule de HCl învecinate, există o forță de atracție între polii opuși ai moleculelor, așa cum se poate vedea mai jos:
Nu te opri acum... Există mai multe după publicitate;)
Această forță atractivă, care se stabilește între capătul negativ al dipolului unei molecule și capătul pozitiv al dipolului unei alte molecule, constituie forța dipol-dipol..
Deci, așa cum spune și numele, dipolul este permanent, deci apare doar în compușii polari. Și cu cât polaritatea unei molecule este mai mare, cu atât interacțiunile dipol-dipol din substanță sunt mai intense.
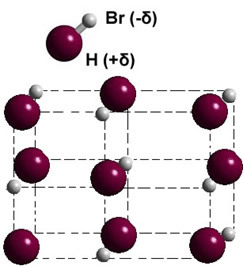
Dacă se află în faza solidă, formarea dipolului permanent ghidează poziția fiecărei molecule în spațiu, formându-se cristale dipolare; ca și în cazul bromurii de hidrogen ilustrate mai jos:
Alte exemple de substanțe polare care au rezistența dipol-dipol între moleculele lor sunt: H2S, CO, HCCl3, NUMAI2.
Această forță intermoleculară este de intensitate medie, deoarece este mai puternică decât forța de atracție a dipolului indusă de dipol, dar mai puțin intensă decât legătura de hidrogen. Acesta este motivul pentru care punctele lor de topire și fierbere sunt mai mari decât cele ale substanțelor care au o rezistență indusă de dipol. Deoarece forța dipol permanentă este mai puternică, este necesar să se furnizeze mai multă energie pentru ca interacțiunile moleculelor sale să se descompună.
De Jennifer Fogaça
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Forța intermoleculară dipol-dipol”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. Accesat la 27 iunie 2021.
e) OS2, HBr, HCI, H2O.
c) Știind că temperaturile de fierbere ale CH3Cl și CH3I sunt 24,0 ° C și respectiv 42,4 ° C, indică ce compus prezintă, în faza lichidă, forțe intermoleculare mai intense.