O Modelul atomic Thomson a fost propus în anul 1898 de către fizicianul englez Joseph John Thomson sau, pur și simplu, de J.J. Thomson. După ce a avut mai multe dovezi experimentale pentru existența electronului, a răsturnat teoria indivizibilității atomului propusă de John Dalton.
Thomson, pe baza modelului său, a confirmat și a dovedit existența electroni (particule cu o sarcină electrică negativă) în atom, adică atomul are particule subatomice.
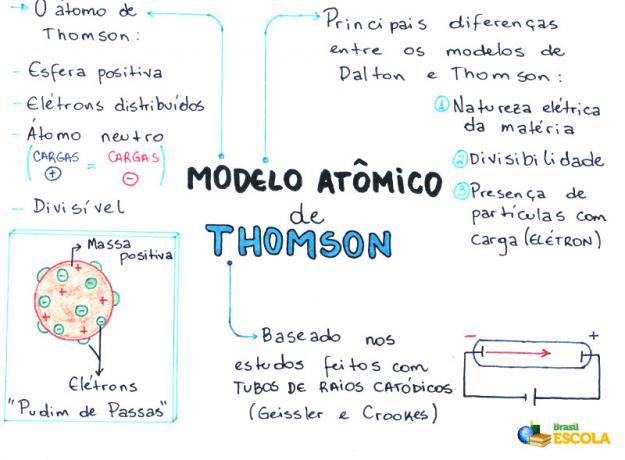
Harta mentală: modelul atomic Thomson
* Pentru a descărca harta mentală în format PDF, Click aici!
Thomson și-a propus modelul său atomic pe baza descoperirilor legate de radioactivitate și a experimentelor efectuate cu tubul catodic construit de oamenii de știință Geissler și Crookes. Vedeți o reprezentare a acestui tub:
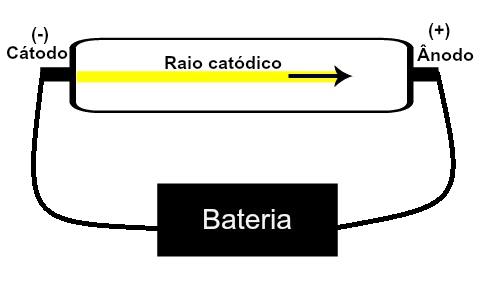
Când un gaz rarefiat, de joasă presiune, este supus unei tensiuni electrice ridicate (de exemplu, 15000 V), acesta produce un fascicul de lumină (compus din sarcini electrice) de la catod (pol negativ) spre anod (pol pozitiv).
Cu acest experiment, Thomson a ajuns la concluzia că atunci când atomii materialului gazos din interior ale tubului au fost supuse unei tensiuni ridicate, electronii lor au fost smulși și direcționați către placă pozitiv.
Considerații propuse de modelul atomic Thomson
Cu experimentele efectuate cu tubul catodic, Thomson a propus interpretarea sa despre cum ar fi atomul și constituția acestuia. Deci, după el:
- Atomul este o sferă, dar nu masivă așa cum a propus-o Model atomic John Dalton;
- Atomul este neutru, întrucât toată materia este neutră;
- Deoarece atomul are electroni, care au sarcini negative, trebuie să aibă particule pozitive, astfel încât sarcina finală să fie nulă;
- Electronii nu sunt fixați sau prinși în atom, pot fi transferați în alt atom în anumite condiții;
- Atomul poate fi considerat ca un fluid continuu cu sarcini pozitive unde ar fi distribuiți electroni, care au o sarcină negativă;
- asociat dvs. modelează o budincă de stafide (care reprezintă electronii);
- Deoarece electronii care sunt împrăștiați au aceeași sarcină, există o respingere reciprocă între ei, care îi face distribuiți uniform în sferă.
Noutăți propuse atomului prin modelul Thomson
Modelul atomic al lui Thomson a fost al doilea propus pentru atom. Primul model a fost formulat de John Dalton.
Nu te opri acum... Există mai multe după publicitate;)
Modelul lui Thomson a tratat noi cunoștințe despre atom care până atunci nu fuseseră propuse din cauza lipsei bazelor științifice, cum ar fi:
- Natura electrică a materiei;
- Divizibilitatea atomului;
- Prezența particulelor mici, încărcate în atom.
Probleme arătate asupra atomului Thomson
Mai mulți fizicieni la momentul propunerii Modelul atomic Thomson, bazat pe teoriile fizicii clasice, a subliniat unele inconsecvențe prezente în acest model:
- Thomson a propus că atomul avea o stabilitate în raport cu distribuția uniformă a electronilor, care ar putea fi modificată de influența energiei. Cu toate acestea, Fizica clasică, bazată pe electromagnetism, nu permite existența unui sistem stabil bazat doar pe repulsia dintre particulele de aceeași sarcină;
- Pentru Thomson, electronii sunt distribuiți uniform în atom, dar au capacitatea de a se schimbă într-un mod accelerat și, prin urmare, trebuie să emită radiații electromagnetice la anumite frecvențe specific. Cu toate acestea, acest lucru nu a fost observat.
- Modelul lui Thomson a fost adesea ineficient în explicarea proprietăților atomice, cum ar fi compoziția și organizarea lor.
* Mind Map de Victor Ricardo Ferreira
Profesor de chimie
De mine. Diogo Lopes Dias
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
ZILE, Diogo Lopes. „Modelul atomic al lui Thomson”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Accesat la 27 iunie 2021.
Chimie

Niels Bohr, atomul lui Bohr, fizica atomică, atomul stabil, modelul atomic, sistemul planetar, straturile electrosferei, niveluri de energie, cochilii de electroni, energie de electroni, model atomic Rutherford, atom de stare excitată.
Chimie

Atomii și construcția Universului, teoria atomică, că totul este făcut, materia este alcătuită din atomi, Teoria celor patru elemente, alchimiștii antici, teoria atomică, particula fundamentală.