Volumul atomic nu este volumul pe care îl ocupă un atom, ci se referă la volum ocupat de o cantitate fixă dintr-un număr dat de atomi ai unui element chimic.
In text Element chimic, s-a arătat că un element corespunde unui set de atomi care au același număr atomic, adică aceeași cantitate de protoni din nucleu. Cantitatea stabilită pentru a calcula volumul atomic este valoarea lui Constanta lui Avogadro, care este egal cu 6,02. 1023 atomi, care corespunde la 1 mol al elementului.
Deci putem spune asta volumul atomic este volumul pe care 1 mol de atomi (sau 6.02). 1023 atomi) unui element ocupă.
Această cantitate poate fi calculată dacă cunoaștem densitatea elementului solid și masa de 1 mol de atomi ai acelui element. De exemplu, considerați că densitatea de sodiu (Na) este egală cu 0,97 g / cm3 și că 6.02. 1023 atomii de sodiu au o masă egală cu 23,0 g. Putem apoi, din formula densității, să ajungem la volumul atomic de sodiu. Vedeți cum:
densitate = Paste
volum
volum atomic = masa de 6,02. 1023 atomi elementari
densitatea elementelor în stare solidă
Volumul atomic de sodiu = 23,0 g
0,97 g / cm3
Volumul atomic de sodiu = 23,71 cm3
Valoarea volumului atomic implică nu numai dimensiunea atomilor, ci și distanța dintre ei. Prin urmare, deoarece implică și spații goale, nu putem ia valoarea volumului atomic și împarte la numărul de atomi (6.02. 1023) pentru a găsi volumul pe care îl ocupă fiecare atom.
Este important să studiați volumul atomic deoarece este o proprietate periodică, adică variază în funcție de numărul atomic al elementului. Uită-te la imaginea de mai jos. Volumul atomic al elementelor crește de sus în jos, ceea ce înseamnă că atunci când analizăm elementele aparținând aceleiași familii ale Tabelului Periodic, pe măsură ce crește numărul atomic, crește și volumul atomic. Acest lucru se datorează faptului că, în acest sens, perioadele cresc, ceea ce înseamnă că straturile electronice ale atomilor cresc și, în consecință, crește și volumul ocupat de aceștia. Acesta este același sentiment de creștere ca și raza atomica.
Pe de altă parte, pe orizontală, vedem că volumul atomic crește de la centru la margini. Când începem de la stânga și mergem la dreapta spre mijlocul Tabelului periodic, volumul atomic scade deoarece perioada este la fel, adică elementele aceleiași linii au aceeași cantitate de straturi electronice, dar numărul atomic va avea crescând. Aceasta înseamnă că cantitatea de electroni crește în această direcție, ceea ce duce la o forță mai mare de atracția electronilor către nucleul atomului, micșorând raza sa atomică și, în consecință, volumul atomic. Dar de la centru la dreapta, acest lucru nu se întâmplă în continuare, deoarece, în cazul elementelor situate în această regiune, mai ales în cazul nemetalelor, distanța dintre atomii lor este relativ mare, ceea ce afectează volumul atomic, mărind-o.
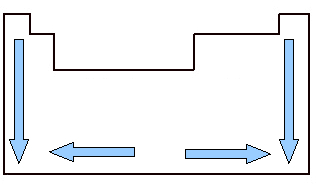
Variația volumului atomic în tabelul periodic între familii și perioade
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/volume-atomico.htm
