Fosfor albeste o formă alotropă a elementului chimic fosfor, reprezentată în mod obișnuit prin formula moleculară P4. În ciuda faptului că este numit fosfor alb, culoarea sa amintește mai mult de ceară sau gălbuie. Fosforul alb este tratat ca fiind cea mai stabilă formă de fosfor, deși nu este cea mai stabilă termodinamic.
Fosforul alb are puține utilizări directe în industrie, fiind în general transformat în alotropul roșu, care are utilizări mai directe și este mai puțin toxic. Cu toate acestea, fosforul alb este folosit în conflictele militare ca agent care provoacă fum, pentru iluminat și, de asemenea, pentru a crea incendii, deoarece fosforul alb se aprinde la contactul cu aerul și la temperaturi puțin mai mari de 30°C °C.
Citeste si: Care sunt formele alotrope ale sulfului?
Subiecte din acest articol
- 1 - Rezumatul fosforului alb
- 2 - Ce este fosforul alb?
- 3 - Compoziția fosforului alb
- 4 - Pentru ce se folosește fosforul alb?
-
5 - Utilizarea fosforului alb în război
- → Bombă cu fosfor alb
- → Efectele expunerii la fosfor alb
- 6 - Diferențele dintre fosforul alb și fosforul roșu
Rezumat al fosforului alb
- Fosforul alb este o formă alotropă a fosforului, reprezentată de formula P4.
- Are o culoare gălbuie, apropiată de culoarea cerii.
- Poate fi produs din roci de fosfat, nisip și cocs la temperaturi ridicate.
- Este foarte slab solubil în apă și se aprinde la temperaturi puțin peste 30°C.
- Nu este utilizat pe scară largă în industrie, dar este principala formă elementară de fosfor produsă.
- Este folosit în conflicte și războaie ca agent care provoacă fum, incendii și pentru iluminat.
- Are utilizări mai directe decât fosforul alb și este, de asemenea, mai puțin toxic decât acesta.
Ce este fosforul alb?
Fosfor alb este una dintre cele 12 forme alotrope care există element chimic fosfor, reprezentat în mod obișnuit ca P4.
În antichitate, urina era singura sursă cunoscută pentru elementul fosfor și, prin urmare, toate studiile asupra acestui element au făcut referire la producția din urină. Fosforul produs în acest proces avea o culoare albă (sau gălbuie, asemănătoare ceară), provocând că fosforul alb a fost prima formă alotropică a acestui element, aducând-o și mai mare faimă.
În posterior, În a doua jumătate a secolului al XIX-lea, s-a descoperit că fosforul alb poate fi produs prin încălzirea rocilor de fosfat., cu nisip și cocs. Această metodă a fost îmbunătățită pentru modul modern de producere a fosforului alb, care constă în utilizarea a cuptor electric (care atinge temperaturi cuprinse între 1.400 și 1.500 °C) pentru încălzirea unei roci de fosfat (Aici3(PRAF4)2), nisip (silice, SiO2) și cocs (carbon).
2Ca3(PRAF4)2 + 6 SiO2 + 10 C → P4 + 6 CaSiO3 + 10 CO
Vaporii de fosfor sunt condensați, formând un solid ceros care este insolubil în apă.
Nu te opri acum... Mai sunt dupa publicitate ;)
Compoziția fosforului alb
Fosfor alb este convențional cea mai stabilă formă de fosfor, deși este, de fapt, metastabil (încălzirea sa duce la formele alotrope termodinamic mai stabile, roșii și negre).
Apare sub formă cristalină ca molecule P4 tetraedric cu legături P─P de lungime egală cu 221 pm. Este solubil în benzen, PCl3 și C.S.2, foarte puțin solubil în apă. De fapt, fosforul alb este stocat în apă pentru a preveni oxidarea acestuia.

În aer umed, suferă o oxidare chemiluminiscentă, emitând o strălucire verde și transformându-se încet în P4O8 si3.
La ce este bun fosforul alb?
Fosfor alb are o largă utilizare în industria militară, ca producator de fum si pentru umplerea proiectilelor si grenadelor.
În industrie, în general, este produs ca fosfor elementar din roci de fosfat, pentru a fi apoi transformat în fosfor roșu, o altă formă alotropă, care are un comportament chimic diferit. Fosforul roșu are o aplicație generală mai mare, fiind folosit la producerea bețelor de chibrit, fosfură de aluminiu, ignifuge și în scopuri pirotehnice. Fosforul alb este, de asemenea, principala modalitate de a produce compuși de puritate mai mare care pot conține fosfor. De asemenea, produce PCl3, prin reacție cu Cl2.
Vezi si: La urma urmei, chibritul este în cutie sau pe stick?
Utilizarea fosforului alb în război
Fosforul alb ajunge să fie folosit în scopuri militare, datorită autoaprinderii sale la temperaturi scăzute: peste 50 °C (unii autori spun că peste 34 °C), în contact cu aerul, fosforul alb se aprinde, producând pentoxid de fosfor (P4O10).
→ Bombă cu fosfor alb
Fosforul alb se aprinde la temperaturi scăzute. De aceea, folosirea fosforului alb ca armă incendiară este comună în conflicte. Utilizarea sa nu se bazează pe letalitate, ci mai degrabă pentru a crea un foc, iluminare sau chiar o cortină de fum pentru a ajuta la evadarea sau retragerea trupelor. Formarea fumului are loc atunci când temperatura este suficient de ridicată în raport cu temperatura de autoaprindere a formei alotropice.

Deoarece există utilizările menționate mai sus ale fosforului alb (iluminare, cortină de fum și promovare a focului), convențiile internaționale nu interzic utilizarea acestuia în conflicte. Convenția ONU privind armele chimice (CWC) nu o consideră o armă chimică. Singura problemă este că, dacă este folosit pentru a incendia oamenii direct țintelor civile, fosforul alb ar putea încălca Protocolul III al Convenției privind anumite arme convenționale (CCCW). Cu toate acestea, acest fapt ar trebui dovedit printr-o anchetă a organelor competente.
→ Efectele expunerii la fosfor alb
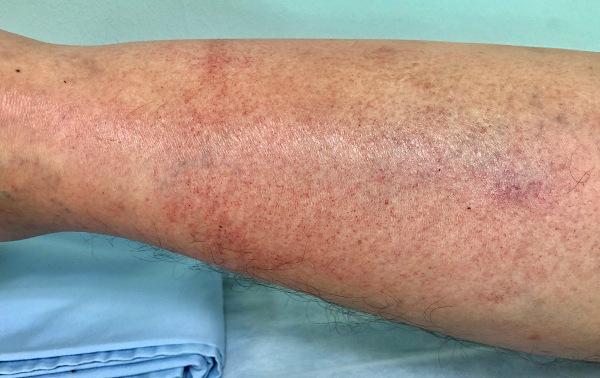
Odată aprins, focul de fosfor alb este greu de stins. Aderă foarte ușor pe piele și îmbrăcăminte, provocând arsuri semnificative. În plus, chiar și după tratamentul inițial, fosforul alb se poate reaprinde dacă este încă în contact cu aerul. Prin urmare, eliminarea oricărei urme de fosfor din răni este esențială.
La început, spălarea cu apă și soluții saline este esențială, deoarece acest lucru nu poate doar reduce temperatura, precum și oprirea arderii și îndepărtarea oricărei urme de acid fosforic diluat pe care o poate avea fost format. Absorbția fosforului de către arsuri poate genera abateri ale nivelurilor de calciu și fosfor din organism, care pot genera rapid hipocalcemie și hiperfosfatemie, care poate fi cauza aritmie cardiacă fatală.
Fumul este extrem de iritant pentru mucoasele, unde se combină cu apa pentru a forma acid fosforic. Inhalarea fumului alb de fosfor provoacă iritație la nivelul căilor respiratorii, generând tuse, cefalee și edem pulmonar întârziat.
Fosforul alb este foarte toxic pentru oameni și este rapid absorbit în sânge și ficat. Ingestia a 100 mg poate fi fatală din cauza insuficienței hepatice. Expunerea lentă și prelungită a cantităților mici provoacă, de asemenea, consecințe oribile. Cea mai frecventă afecțiune este potrivi falca, care a afectat mai mulți muncitori din fabricile de fosfor la sfârșitul secolului al XIX-lea și începutul secolului al XX-lea.
Diferențele dintre fosforul alb și fosforul roșu
Fosfor alb și roșu sunt diferite forme alotrope ale elementului chimic fosfor, ambele reprezentate de P4.
Fosforul roșu poate fi obținut din fosforul alb prin încălzirea acestuia, într-o atmosferă inertă, la o temperatură în intervalul 540 K (267 °C). A fost obținut pentru prima dată de Anton von Schötter în 1845.
Există mai multe forme cristaline de fosfor roșu. Unul dintre ele este Hittorf (cunoscut și sub numele de fosfor violet), care constă dintr-un lanț lung și complex de fosfor.
Fosforul roșu este mai puțin dens decât albul, are un punct de topire mai mare și este mai puțin reactiv. În plus, fosforul roșu nu este considerat toxic, ceea ce îl face mai ușor și mai sigur de manipulat.
Surse
CHOU, T.-D.; LEE, T.-W.; CHEN, S.-L.; TUNG, Y.-M.; DAI, N.-T.; CHEN, S.-G.; LEE, C.-H.; CHEN, T.-M.; WANG, H.-J. Managementul arsurilor de fosfor alb. Arsuri, n. 27, p. 492-497, 2001.
HOUSECROFT, C. ȘI.; SHARPE, A. G. Chimie anorganică. 2. ed. Pearson Education Limited: Londra, 2005.
Kelly, P. F. Fosfor: Chimie anorganică. În: Enciclopedia de chimie anorganică. 2. ed. Wiley: New Jersey, 2005.
ORGANIZAȚIA MONDIALĂ A SĂNĂTĂȚII. Fosfor alb. Organizația Mondială a Sănătății, 20 oct. 2023. Disponibil in: https://www.who.int/news-room/fact-sheets/detail/white-phosphorus.
Doriți să faceți referire la acest text într-o lucrare școlară sau academică? Uite:
NOVAIS, Stéfano Araújo. „Fosfor alb”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/fosforo-branco.htm. Accesat pe 9 noiembrie 2023.