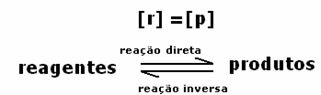
Echilibrul dinamic sau echilibrul chimic al unei reacții are loc atunci când reacțiile înainte și inversă apar simultan. Aceste așa-numite sisteme reversibile sunt reprezentate de săgeți în ambele direcții:  sau
sau  . Un exemplu de reacție reversibilă este citat în imaginea de mai sus, între gaz iod și hidrogen gazos.
. Un exemplu de reacție reversibilă este citat în imaginea de mai sus, între gaz iod și hidrogen gazos.
La începutul reacției, cantitatea de reactanți este maximă, iar cea a produselor este zero. Cu toate acestea, reactanții reacționează între ei, scăzându-și concentrația și crescând cele ale produselor formate. Rata de dezvoltare a reacției directe este, de asemenea, în scădere.
Pe măsură ce concentrația produselor crește, reacția inversă începe și reactanții se formează din nou; crește și rata de dezvoltare a reacției inverse.
La atingerea echilibrului chimic, la temperatură constantă, ratele de dezvoltare ale reacțiilor înainte și invers sunt egale.
Toatedirect = Toate invers
Ratele sunt aceleași, dar concentrațiile nu. Este puțin probabil ca concentrațiile de reactivi și produse să fie aceleași. Numai în cazuri rare se întâmplă acest lucru. În majoritatea cazurilor, concentrația reactivilor va fi mai mare decât cea a produselor sau invers.
Astfel, avem trei modalități posibile de a reprezenta grafic ratele de dezvoltare ale reacții directe și inverse, care raportează concentrațiile reactanților și produselor peste timp. Să analizăm fiecare caz:
Primul caz: Concentrații egale:
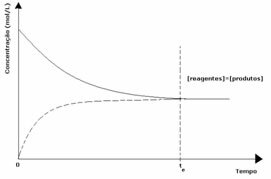
După cum se vede în grafic, la momentul tși reacțiile înainte și inversă sunt aceleași, caz în care concentrațiile de reactanți și produse sunt aceleași. Astfel, echilibrul nu este deplasat pe ambele părți, intensitatea ambelor reacții este aceeași, așa cum se exprimă mai jos:
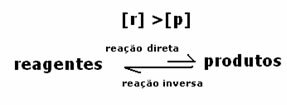
Al doilea caz: Concentrația reactivilor mai mare decât concentrația produselor:
În acest caz, se observă că la atingerea echilibrului, concentrația reactivilor este mai mare decât cea a produselor. Astfel, se concluzionează că, dacă există mai mult reactant, reacția inversă are loc cu o intensitate mai mare. Reacția este deplasată spre stânga:
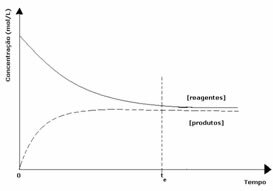
Al treilea caz: Concentrația produselor mai mare decât cea a reactivilor:
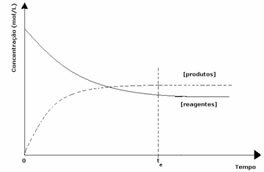
Deoarece la echilibru concentrația produselor este mai mare, aceasta înseamnă că reacția este s-a deplasat spre dreapta, deoarece reacția directă (cu formarea produselor) are loc cu mai mare intensitate.
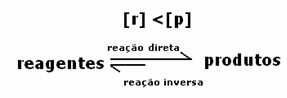
Ceea ce va indica dacă reacția tinde spre dreapta sau spre stânga va fi constanta de echilibru K, care depinde doar de temperatură.
De Jennifer Fogaça
Absolvent în chimie
Echipa școlii din Brazilia
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm

