Reacții de oxidare-reducere care apar în prezența peroxidului de hidrogen (soluție apoasă de peroxid de hidrogen - H2O2 (aq)) constituie un caz special care trebuie analizat separat, în principal în ceea ce privește echilibrul acestuia. Acest lucru se datorează faptului că oxigenii din peroxidul de hidrogen, care au Nox egal cu -1, se pot oxida sau reduce.
De exemplu, să analizăm două cazuri în care se comportă mai întâi ca agent oxidant (reducător) și apoi ca agent reducător (oxidant):
- agent oxidant: ori de câte ori peroxidul de hidrogen este redus, acționând ca agent oxidant, generează apă ca produs.
Dacă adăugăm o soluție de peroxid de hidrogen la o soluție care conține ioni de iod (I-) într-un mediu acid, vom avea:
H2O2 (aq) + Eu-(Aici) + H+(Aici) → H2O(1) + Eu2 (e)
Vedeți că se formează apă și iod. Dar pentru a verifica dacă peroxidul de hidrogen a acționat efectiv ca agent oxidant și a fost redus, respectați determinarea numerelor de oxidare (NOx): *

Oxigenul Nox al peroxidului de hidrogen a scăzut de la -1 la -2, dat fiind că a primit 1 electron. Cu toate acestea, deoarece avem doi oxigeni în fiecare moleculă de peroxid de hidrogen (H
2O2), variația Nox va fi egală cu 2.Deci, așa cum se arată în textul „Echilibrarea redox”, Un pas necesar pentru echilibrarea reacțiilor prin metoda de oxidare-reducere este inversarea valorilor variațiilor lui Nox cu coeficienții, fiind, în acest caz, după cum urmează:
* H2O2 = 2 (∆Nox) = 2 → 2 va fi coeficientul I-;
* Eu-= ∆Nox = 1 → 1 va fi coeficientul lui H2O2.
Astfel, avem:
1 oră2O2 (aq) + 2 eu-(Aici) + H+(Aici) → H2O(1) + Eu2 (e)
Atingerea celorlalți coeficienți prin echilibrare prin încercări:
- Deoarece există doi atomi de oxigen în primul element, coeficientul de apă din al doilea element trebuie să fie egal cu 2. Și întrucât există și doi ioni de iod în primul membru, coeficientul de iod din al doilea membru va fi 1. Nu uitați că trebuie să înmulțim indicele cu coeficientul pentru a găsi cantitatea corectă de atomi și ioni din fiecare membru:
1 oră2O2 (aq) + 2 eu-(Aici) + H+(Aici) → 2 H2O(1) + 1 eu2 (e)
- Acum rămâne doar să echilibreze cationul de hidrogen al primului membru, iar coeficientul său va trebui să fie egal cu 2, deoarece în al doilea membru are 4 hidrogeni și în primul membru are deja doi:
1 oră2O2 (aq) + 2 eu-(Aici) +2 H+(Aici) → 2 H2O(1) + 1 eu2 (e)
- agent de reducere: ori de câte ori peroxidul de hidrogen se oxidează, acționând ca un agent reducător, generează oxigen (O2) ca produs.
Un exemplu în care peroxidul de hidrogen se reduce este atunci când intră în contact cu permanganatul de potasiu (KMnO4). Această substanță are o culoare violetă foarte caracteristică, dar când vine în contact cu peroxidul de hidrogen, devine incoloră. Acest lucru se datorează faptului că tot manganul este prezent în ionul MnO4- din soluția de permanganat este redusă, dând naștere ionului Mn2+, așa cum se arată mai jos:
+1 -1 +7 -2 +1 0 +2 +1 -2
H2O2 + MnO4-+ H+ →2 + Mn2++ H2O
Calculând Nox, vedem că oxigenul din peroxidul de hidrogen oxidează de fapt și determină reducerea manganului:
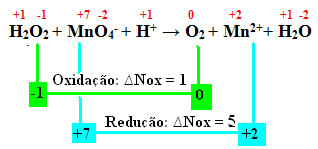
La fel ca în exemplul anterior, ∆Nox de peroxid de hidrogen va fi egal cu 2, deoarece există doi oxigeni și fiecare pierde un electron. Prin urmare, avem:
* O2 = 2 (∆Nox) = 2 → 2 va fi coeficientul de MnO4-;
* MnO4- = ∆No = 5 → 5 va fi coeficientul O2.
Și ca toate O2 provine din peroxid de hidrogen, cele două substanțe au același coeficient:
5 H2O2 + 2MnO4-+ H+ → 5 O2 + Mn2++ H2O
Echilibrând prin metoda de încercare, avem:
5 ore2O2 + 2 MnO4-+ 6 H+ → 5 O2 + 2 Mn2++ 8 ore2O
* Pentru orice întrebări despre cum se calculează numărul de oxidare (Nox) al atomilor și ionilor într-o reacție, citiți textul „Determinarea numărului de oxidare (Nox)”.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm