THEosmoză si trecerea solventului, de la o soluție mai puțin concentrată la o soluție mai concentrată, printr-o membrană semi-permeabilă, până când presiunea exercitată de soluția asupra membranei împiedică trecerea solventului. Acest proces este destinat echilibrează concentrația soluției.
Citește și tu: Solut și solvent
presiune osmotica
THE presiune osmotica si presiunea exercitată asupra soluției cu o concentrație mai mare astfel încât osmoza să nu apară, adică să nu traverseze solventul membrana semipermeabilă.
Presiunea osmotică este utilizată în procesele de desalinizarea apei, forțând procesul de osmoza inversa, determinând trecerea solventului de la soluția mai concentrată la cea mai puțin concentrată. Noi numim acest proces osmoza inversa. Vedeți următoarea imagine care compară cele două procese:
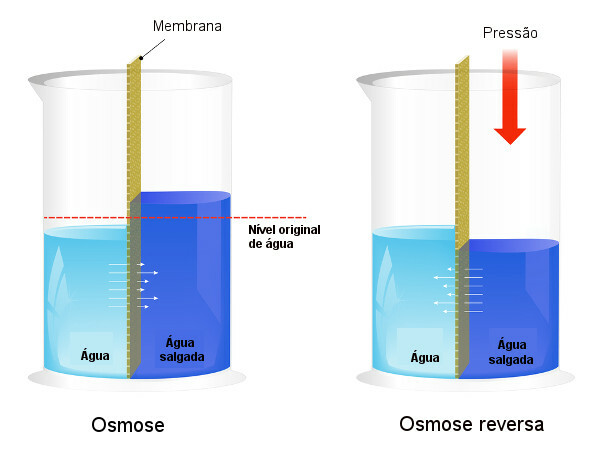
Rețineți că, în osmoză, trecerea solventului este în direcția celei mai concentrate soluții și că, în osmoză inversă, trecerea este în direcția opusă, datorită presiunii aplicate. Pentru a afla mai multe despre subiect, citiți textul nostru:
presiune osmotica.știu mai multe: Osmoza inversă în desalinizarea apei de mare
ecuația presiunii osmotice
Presiunea osmotică, reprezentată de literă pi (π) unei soluții, poate fi calculată prin următoarea ecuație:
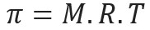
M = concentrația în mol / L
R = constanta universală a gazelor perfecte
T = temperatura absolută, în K
ca alții proprietati coligative, presiunea osmotică depinde de concentrația soluției, adică, cu cât este mai mare concentrația soluției, cu atât este mai mare efectul osmozei asupra soluțiilor și, prin urmare, cu atât este mai mare presiunea osmotică.
Exemple
Osmoza apare în viața noastră de zi cu zi în momente diferite. Putem cita exemplul proces de sărare a cărnii pentru dumneavoastră conservare. Tu microorganisme care ar cauza degradarea cărnii pierde apadin interior spre exterior, care are o concentrație de sare, ceea ce face ca alimentele să dureze mai mult.
Datorită sării, se întâmplă și ca frunzele unei salate se ofilesc pentru pierderea apei din interiorul lor celule (un pic mai puțin concentrat) pentru soluție temperată în mediul extern.
Osmoza este, de asemenea, importantă atunci când vorbim despre sânge uman. Spunem că Celule rosii iar sângele este unul mediu izotonic, adică au aceeași presiune osmotică, permițând intrarea și ieșirea apei din celulă cu ușurință.
Cu toate acestea, atunci când sângele devine mai puțin concentrat decât în interiorul globulelor roșii (mediu hipoton), trecerea apei va avea loc mai ușor în interiorul celulei, făcând-o umflați până la izbucnire. Dacă sângele atinge o concentrație mai mare decât concentrația celulei roșii (mediu hipertonic), celulele sanguine se ofilesc, pe măsură ce pierd apă.

Prin același principiu de conservare a cărnii, conservarea fructelorîn compoturile de bomboane, care conservă mâncarea datorită concentrație mare de zahăr în soluție.
Următoarele sunt alte exemple în care apare osmoza:
- în creșterea sevei în vasele conductoare ale plantei;
- la hemodializă;
- în trecerea selectivă a nutrienților în celulele corpului uman.
Pentru a înțelege cum se întâmplă osmoza în celula animală, celula vegetală și alte probleme biologice, citiți: Osmoza: ce este și cum apare în celula animală și vegetală.
De Victor Ferreira
Profesor de chimie

