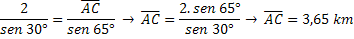THE Teoria Octetului afirmă că pentru ca un atom al unui element chimic să fie stabil, acesta trebuie să dobândească configurația electronică a unui gaz nobil, adică trebuie să aibă opt electroni în învelișul de valență sau doi electroni în cazul în care atomul are doar prima înveliș de electroni. (K).
Beriliul are un număr atomic egal cu 4. Prin urmare, atomul dvs. are 4 electroni și distribuția sa electronică în starea fundamentală este dată de:

Configurație electronică de beriliu
Aceasta înseamnă că beriliu are 2 electroni în ultima sa coajă, fiind din familia 2A (metale alcalino-pământoase). Astfel, ar avea tendința de a dona acești doi electroni, obținând încărcătura 2+, adică ar avea tendința de a forma legături ionice.
Cu toate acestea, se observă că atomii de beriliu fac legături covalente, cu partajarea electronilor, așa cum se arată în compusul format mai jos, hidrură de beriliu (BeH2):

Formarea de legături covalente de beriliu cu hidrogen
Rețineți că, în acest caz, beriliul este stabil cu mai puțin de opt electroni în coaja de valență, deoarece împărtășesc electronii ca atomii de hidrogen, acum are patru electroni în ultimul său strat. Este, prin urmare, un
excepție de la regula octetului.Dar legătura covalentă apare de obicei deoarece elementul are orbitali incompleti. De exemplu, așa cum se arată mai jos, hidrogenul are un orbital incomplet, deci face o singură legătură covalentă. Oxigenul are doi orbitali incompleti și face două legături covalente. La rândul său, azotul are trei orbitali incompleti și, în consecință, face trei legături covalente:

Distribuții electronice de hidrogen, oxigen și azot
Cu toate acestea, așa cum s-a arătat deja, beriliul nu are orbitale incomplete.
Deci, de ce face legături covalente?
Explicația este în teoria hibridizării, care spune asta atunci când un electron dintr-un orbital primește energie, acesta „sare” la un orbital extrem de gol, rămânând în starea excitată și astfel are loc fuziunea sau amestecarea orbitalilor atomici incompleti, generatoare orbitali hibrizi care sunt echivalente între ele și diferite de orbitalele pure originale.
De exemplu, în cazul beriliului, un electron din subnivelul 2 primește energie și trece la un orbital subnivel 2p care era gol:

Starea excitată de beriliu pentru formarea orbitalilor hibrizi
În acest fel, beriliu are doi orbitali incompleti, putând realiza două legături covalente.
Rețineți că un orbital se află într-un subnivel „s”, iar celălalt este în „p”, deci legăturile pe care le-ar efectua beriliu ar trebui să fie diferite. Cu toate acestea, nu asta se întâmplă, deoarece cu fenomenul de hibridizare, aceste orbitale incomplete care s-au format se vor amesteca, generând doi orbitați numiți hibrizi sau hibridizat, care sunt egale între ele. Mai mult, deoarece acești doi orbitali hibrizi provin dintr-un orbital „s” și un orbital „p”, spunem că această hibridizare este de tipul sp:

Formarea hibridizării berilului sp
Deoarece orbitalii hibrizi sunt aceiași, legăturile covalente pe care beriliul le face cu atomii de hidrogen vor fi, de asemenea, aceleași:

Interpenetrări ale orbitalilor hibrid beriliu cu s orbitali ai hidrogenilor
Rețineți că face apoi două legături sigma care sunt de tip s-sp (σs-sp).
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/hibridizacao-berilio.htm